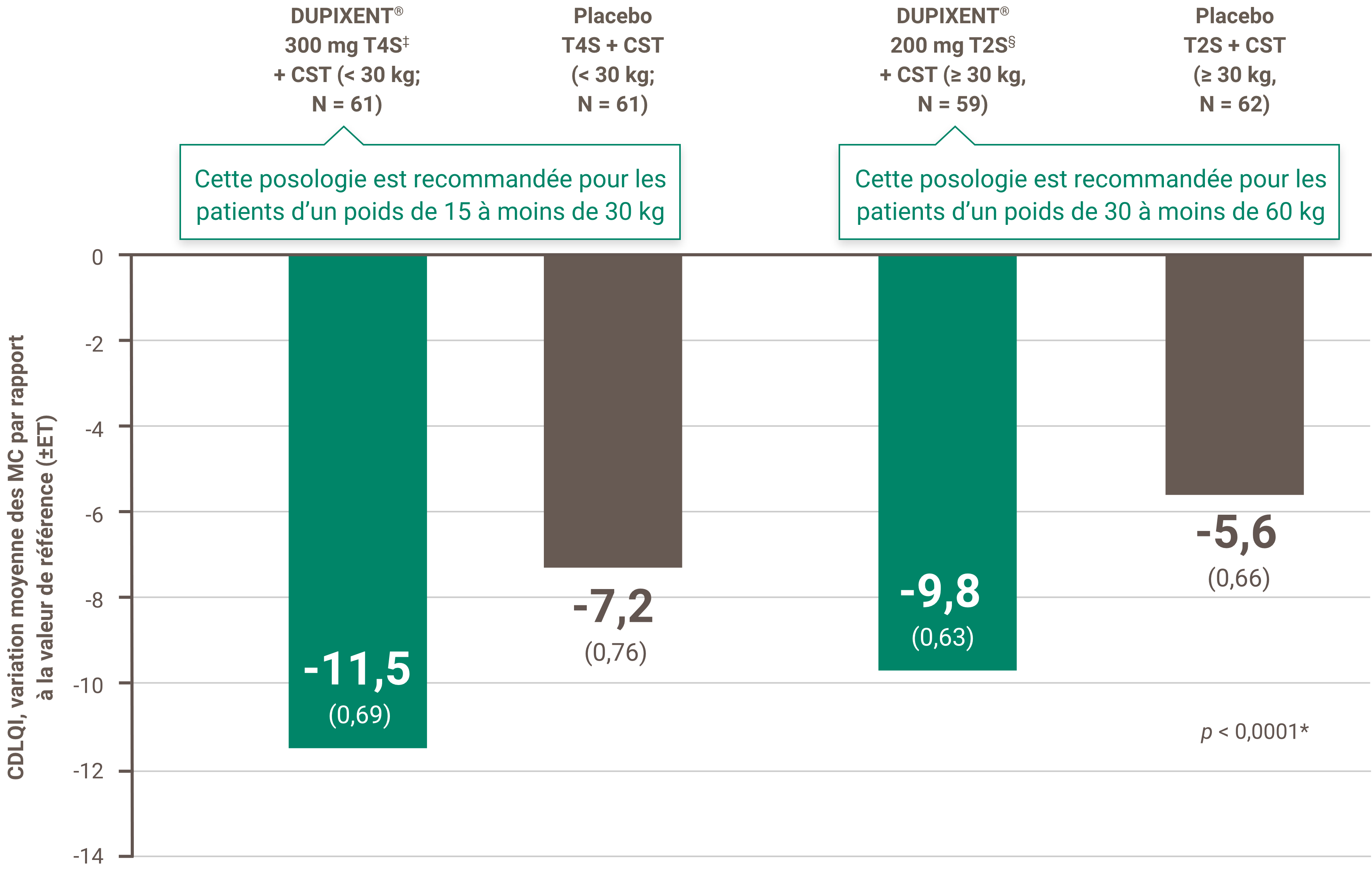
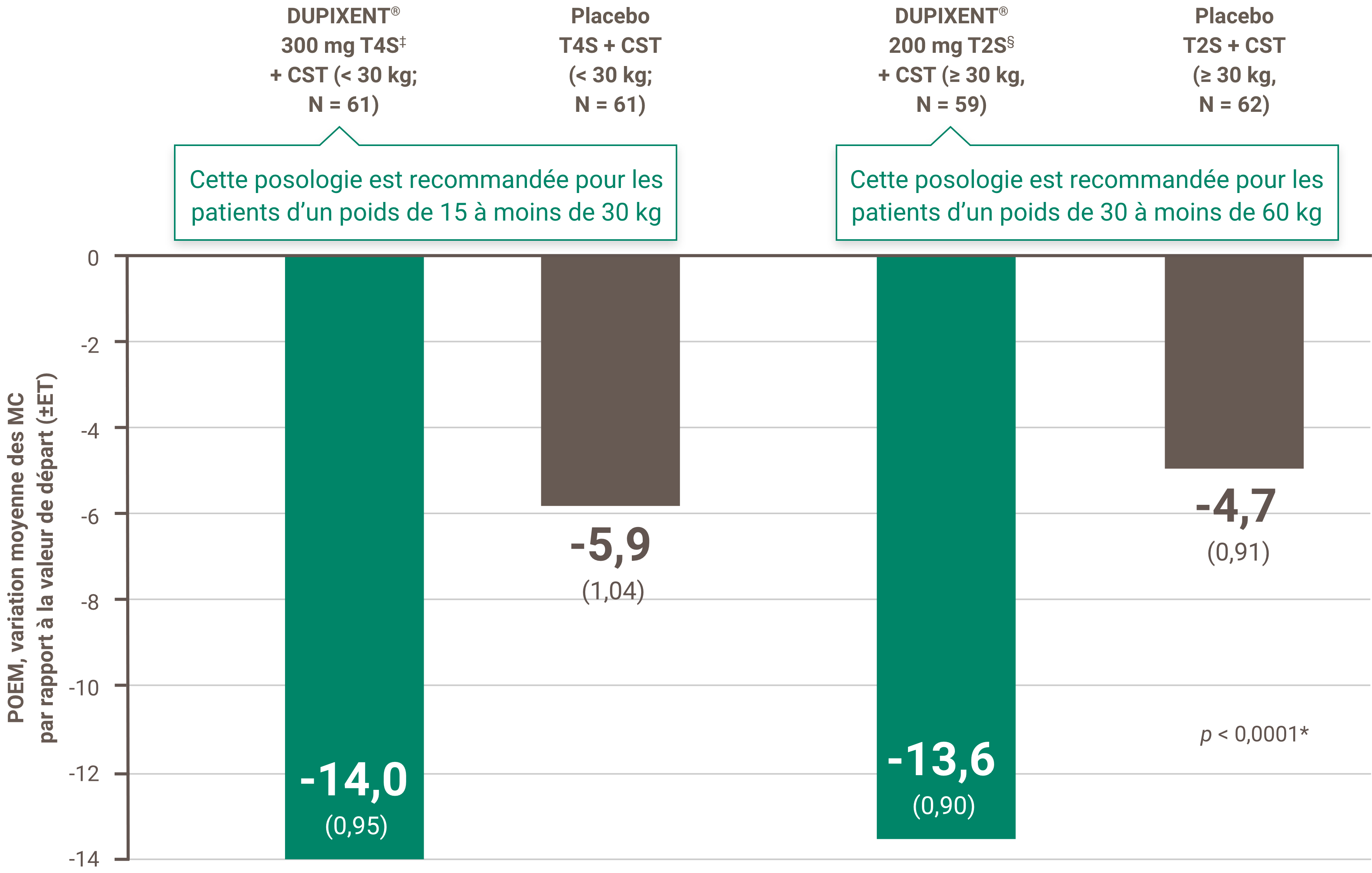
Critères de couverture de DUPIXENT® sur la liste des médicaments de la Saskatchewan (statut de médicament d’exception [SME])19
Pour faire une demande de SME, les prescripteurs autorisés devront procéder par téléphone, par courrier ou par télécopieur.
Pour le traitement de la dermatite atopique modérée à sévère1 chez les patients âgés de 12 ans et plus :
• dont la maladie n’est pas adéquatement maîtrisée par des traitements topiques sur ordonnance, ou lorsque ces traitements ne sont pas appropriés, ET
• qui ont subi un essai adéquat avec une réponse inadéquate, ou qui sont intolérants à chacune des thérapies suivantes : photothérapie (lorsqu’elle est disponible), méthotrexate et cyclosporine, ou encore qui ne sont pas admissibles à ces thérapies.
Les demandes doivent inclure la documentation du score de l’indice d’étendue et de gravité de l’eczéma (EASI, pour Eczema Area and Severity Index) et du score de l’évaluation globale du médecin (POEM, pour Physician Global Assessment).
Approbation initiale : Six (6) mois.
Critères de renouvellement
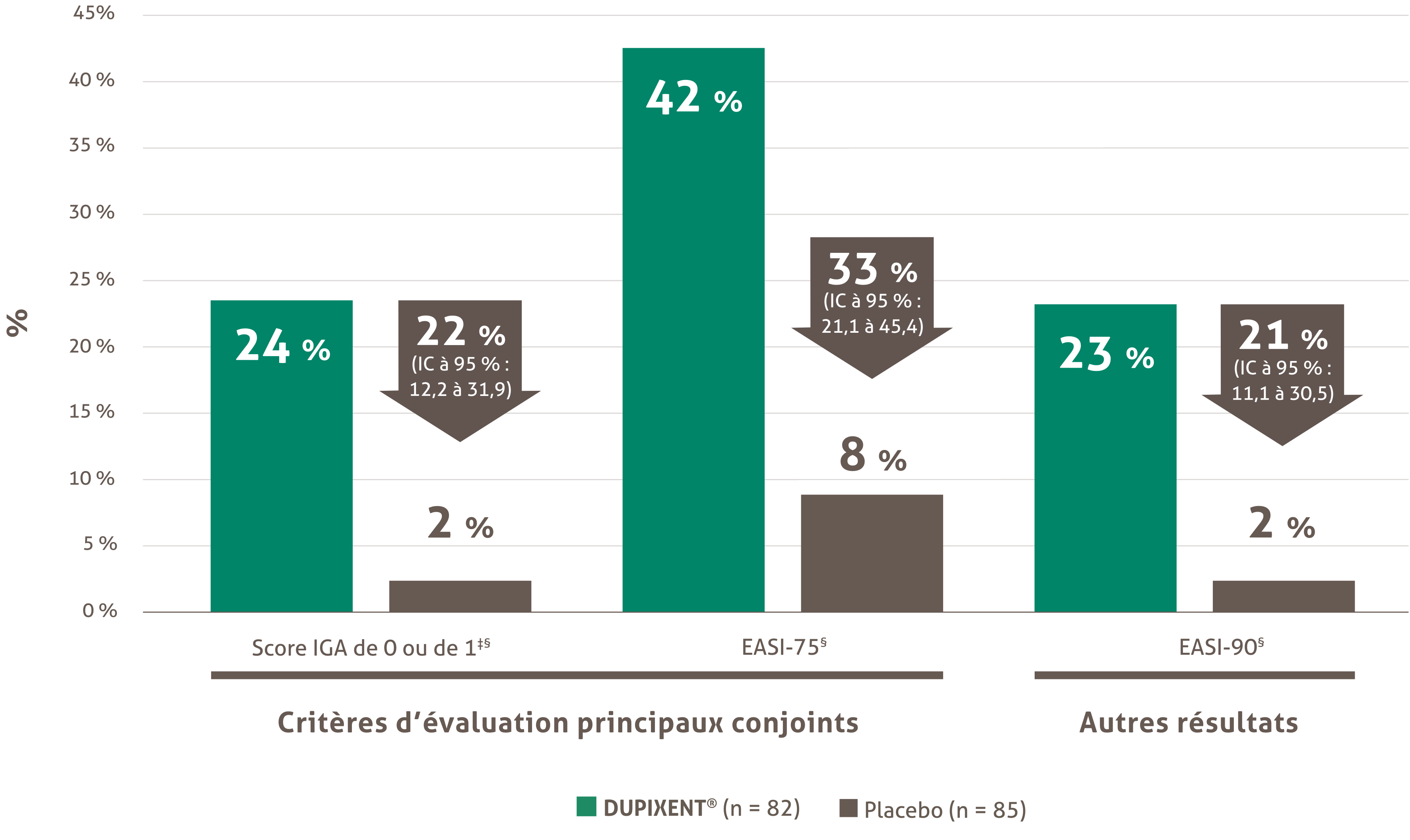
Les demandes de renouvellement seront prises en compte pour les patients pour lesquels une amélioration de 75 % ou plus du score EASI (EASI-75) par rapport à la référence a été observée six mois après le début du traitement et pour lesquels cette réponse est maintenue par la suite tous les six mois.
Les demandes de renouvellement doivent inclure le score EASI récent.
Approbation du renouvellement : Six (6) mois.
Les demandes de couverture pour cette indication doivent être faites par, ou en consultation avec un dermatologue.
1 La dermatite atopique modérée à sévère est définie en fonction d’un score EASI de 16 points ou plus; ou d’un score de l’évaluation globale du médecin de 3 ou 4.
Critères de couverture de DUPIXENT® en vertu de la Liste des médicaments admissibles du Manitoba (statut de médicament d’exception [SME])20
Pour soumettre une demande de SME, les prescripteurs autorisés devront remplir un formulaire.
Pour le traitement de la dermatite atopique uniquement si les conditions suivantes sont remplies :
Critères d’initiation
• Patients de 12 ans ou plus atteints de dermatite atopique modérée à sévère chez qui la maladie n’est pas adéquatement maîtrisée par des traitements topiques sous ordonnance ou lorsque ces traitements ne sont pas appropriés.
• Les patients doivent avoir subi un essai adéquat ou n’être admissible à aucune des thérapies suivantes : photothérapie (lorsqu’elle est disponible), méthotrexate et cyclosporine.
• Les patients qui ont eu subi un essai adéquat de photothérapie, de méthotrexate et/ou de cyclosporine doivent présenter une maladie réfractaire ou une intolérance documentées.
• Le médecin doit fournir le score de l’indice d’étendue et de gravité de l’eczéma (EASI, pour Eczema Area and Severity Index) et le score de l’évaluation globale du médecin (Physician Global Assessment) au moment de la demande initiale de remboursement.
• La durée maximale de l’autorisation initiale est de six mois.
Critères de renouvellement
• Le médecin doit fournir la preuve d’un effet clinique bénéfique lorsqu’il demande la poursuite du remboursement. Cet effet bénéfique est défini comme une amélioration de 75 % ou plus par rapport à la référence du score EASI (EASI-75) six mois après le début du traitement.
• Pour avoir accès à des autorisations ultérieures, le médecin doit fournir tous les six mois la preuve du maintien de la réponse EASI-75 par rapport à la référence.
Conditions de prescription
• Le patient doit être pris en charge par un dermatologue.
• Dupilumab ne doit pas être utilisé en association avec la photothérapie ou les immunosuppresseurs (p. ex., méthotrexate, cyclosporine).
IEGE : Eczema Area and Severity Index (Indice d’étendue et de gravité de l’eczéma)
Critères de couverture de DUPIXENT® en Ontario en vertu du Programme d’accès exceptionnel (PAE)21
Pour soumettre une demande au PAE, les prescripteurs autorisés devront remplir un formulaire.
Critères d’initiation
DUPIXENT® est utilisé pour traiter la dermatite atopique modérée à sévère chez un/e patient/e qui répond aux critères suivants :
- doit être âgé de 12 ans ou plus; et
- a reçu un diagnostic de dermatite atopique modérée à sévère telle que définie par un score EASI (Eczema Area and Severity Index) supérieur ou égal à 16 points; et
- n’a pas réussi à maintenir un contrôle adéquat de sa dermatite avec des thérapies topiques sur ordonnance (si ces thérapies ne sont pas recommandées, le prescripteur autorisé doit fournir les raisons pour lesquelles elles ne pourraient pas être utilisées avec la demande au PAE); et
- a subi un échec ou a présenté une intolérance lors d’un essai adéquat de photothérapie (lorsqu’elle est disponible), de méthotrexate et de cyclosporine1; et
- DUPIXENT® est prescrit au patient par un dermatologue, un pédiatre ou un immunologue; ou en consultation avec l’un de ces spécialistes et le prescripteur autorisé inclut la note de consultation avec la demande au PAE.
Critères d’exclusion : (Les patients répondant à l’un des critères suivants ne recevront pas de financement)
- DUPIXENT® ne sera pas financé s’il est utilisé en association avec une photothérapie ou des médicaments immunosuppresseurs (par exemple, méthotrexate, cyclosporine)
- DUPIXENT® ne sera pas financé en association avec d’autres agents biologiques utilisés pour la dermatite atopique.2
Remarques :
1Pour chaque traitement utilisé, produisez la documentation de la maladie réfractaire et/ou de l’intolérance (y compris une description de l’effet indésirable et de la gravité de la réaction). Si un patient ou une patiente n’est pas jugé admissible ou fait l’objet d’une contre-indication au traitement, indiquez la ou les raisons de son inadmissibilité.
2L’utilisation concomitante du dupilumab en association avec d’autres produits biologiques utilisés pour d’autres pathologies sera considérée au cas par cas.
Critères de renouvellement
Premier renouvellement :
Le renouvellement du financement sera envisagé pour les patients dont les bénéfices du traitement sont documentés. Le bénéfice du traitement est défini comme une amélioration de 75 % ou plus du score EASI (Eczema Area and Severity Index) (EASI-75) par rapport à la référence dans les six mois suivant le début du traitement.
Renouvellements ultérieurs :
Le renouvellement ultérieur du financement sera envisagé pour les patients qui maintiennent une amélioration de 75 % ou plus de la réponse à l’EASI-75 par rapport à la référence.
Durée d’approbation des demandes initiales : 6 mois
Durée d’approbation pour le premier et le deuxième renouvellement : 6 mois
Durée d’approbation pour le troisième renouvellement et les renouvellements ultérieurs : 1 an
Critères de couverture de DUPIXENT® au Québec sur la liste des médicaments d’exception de la RAMQ*22
Pour le traitement de patients âgés de 12 ans et plus atteints d’une dermatite atopique chronique modérée à sévère :
- en présence d’un score d’au moins 16 sur l’EASI ou lorsque le visage, les paumes, la plante des pieds ou la zone génitale sont gravement affectés; et
- en présence d’un score d’au moins 8 sur le DLQI ou cDLQI; et
- où 10 % ou plus de la surface corporelle est affectée, sauf dans les cas où le visage, les paumes, la plante des pieds ou la zone génitale sont gravement affectés; et
- où la maladie est insuffisamment contrôlée malgré l’utilisation de traitements topiques comprenant au moins deux corticostéroïdes topiques moyens ou forts et un inhibiteur topique de la calcineurine; et
- lorsqu’un traitement photothérapeutique d’au moins 30 séances pendant trois mois n’a pas permis de contrôler de façon optimale la maladie, sauf si ce traitement est contre-indiqué, non toléré ou inaccessible, ou lorsqu’un traitement d’au moins 12 séances pendant un mois n’a pas fourni d’amélioration importante des lésions.
La demande initiale est autorisée pour une durée maximale de quatre mois. Lors de demandes ultérieures, le médecin doit fournir des informations permettant d’établir les effets bénéfiques du traitement, à savoir : une amélioration d’au moins 75 % du score EASI par rapport au niveau de base; ou une amélioration d’au moins 50 % du score EASI et une diminution d’au moins cinq points du questionnaire DLQI ou cDLQI par rapport au niveau de base; ou une diminution marquée des lésions au visage, aux paumes, à la plante des pieds ou à la zone génitale comparativement à l’évaluation pré-traitement et une diminution d’au moins cinq points du questionnaire DLQI ou cDLQI par rapport au niveau de base.
Les demandes de poursuite du traitement sont autorisées pour une durée maximale de 12 mois. Les autorisations pour le dupilumab sont accordées pour une dose initiale maximale de 600 mg suivie d’une dose maximale de 300 mg T2S.
* Marque officielle de la Régie de l’assurance maladie du Québec.
Critères de couverture de DUPIXENT® par les régimes d’assurance-médicaments du Nouveau-Brunswick (autorisation spéciale)23
Pour demander une couverture en vertu d’une autorisation spéciale, les prescripteurs autorisés devront remplir un formulaire.
Pour le traitement de la dermatite atopique modérée à sévère chez les patients âgés de 12 ans et plus, qui satisfont à tous les critères suivants :
• Réfractaires ou présentant des contre-indications à un essai adéquat de traitements topiques sur ordonnance
• Réfractaires, intolérants ou présentant des contre-indications à un essai adéquat de photothérapie (le cas échéant), de méthotrexate et de cyclosporine
• Score de référence de l’évaluation globale du médecin égal ou supérieur à 3 et score d’étendue et de gravité de l’eczéma égal ou supérieur à 7,1
Critères de renouvellement
• Les demandes de renouvellement doivent fournir la preuve de l’effet clinique bénéfique caractérisé par une amélioration de 75 % ou plus du score de l’indice d’étendue et de gravité de l’eczéma (Eczema Area and Severity Index, EASI-75) par rapport à la référence six mois après l’instauration du traitement.
• La preuve du maintien de la réponse EASI-75 par rapport à la référence doit être fournie pour les autorisations ultérieures.
Notes cliniques :
• Ne pas utiliser en association avec la photothérapie ou les immunosuppresseurs (p. ex., méthotrexate, cyclosporine).
Notes de réclamation :
• Ce produit doit être prescrit par un dermatologue.
• Les approbations porteront sur un maximum de 600 mg à la semaine 0, puis 300 mg toutes les deux semaines par la suite.
• Période d’approbation initiale : 6 mois.
• Période d’approbation du renouvellement : 1 an.
Critères de couverture de DUPIXENT® en vertu du Programme des services de santé non assurés couvrant les Premières Nations et les Inuits (avantage à usage limité)24
Critères de couverture de DUPIXENT en vertu du Programme des services de santé non assurés couvrant les Premières Nations et les Inuits (avantage à usage limité)27
Pour l’approbation, les prescripteurs autorisés devront remplir un formulaire de demande de médicaments à usage limité.
Critères de couverture/Remarques thérapeutiques
Avantage à usage limité (approbation préalable requise).
Critères de couverture initiaux (4 mois) :
Pour les patients âgés de 12 ans et plus atteints de dermatite atopique chronique modérée à sévère qui répondent à tous les critères suivants :
• le patient ou la patiente présente un score égal ou supérieur à 16 sur l’Indice de surface et de gravité de l’eczéma (EASI, Eczema Area and Severity Index); et
• le patient ou la patiente présente un score supérieur ou égal à 8 sur l’indice dermatologique de la qualité de vie (DLQI, pour Dermatology Life Quality Index) ou sur l’indice dermatologique pédiatrique de la qualité de vie (Children’s Dermatology Life Quality Index, CDLQI); et
• la surface corporelle (SC) atteinte est d’au moins 10 %; et
• la maladie est insuffisamment contrôlée malgré l’utilisation de traitements topiques comprenant au moins deux corticostéroïdes topiques de puissance moyenne ou élevée et un inhibiteur topique de la calcineurine; et
• il y a intolérance ou absence de réponse à la photothérapie ou aucun accès à la photothérapie.
Critères de renouvellement ou de couverture initiale chez les patients actuellement maintenus sous DUPIXENT® (12 mois) :
• le patient ou la patiente constate une amélioration d’au moins 75 % du score EASI par rapport au niveau de référence; ou
• le patient ou la patiente constate une amélioration d’au moins 50 % du score EASI; et
• le patient ou la patiente a présenté une diminution d’au moins cinq points au questionnaire DLQI ou CDLQI par rapport à la référence.
Critère de couverture de DUPIXENT® sur le formulaire Pharmacare de l’Î.-P.-É. via le programme pour les médicaments onéreux ou le Programme de couverture des coûts exorbitants en médicaments26
Pour l’approbation, les prescripteurs autorisés devront remplir un formulaire de demande.
Pour le traitement de la dermatite atopique modérée à sévère chez les patients âgés de 12 ans et plus, qui satisfont à tous les critères suivants :
• Réfractaires ou présentant des contre-indications à un essai adéquat de traitements topiques sur ordonnance
• Réfractaires, intolérants ou présentant des contre-indications à un essai adéquat de photothérapie (le cas échéant), de méthotrexate et de cyclosporine.
• Score de l’indice d’étendue et de gravité de l’eczéma (EASI, pour Eczema Area and Severity Index) de ≥ 7,1 et Score de l’évaluation globale du médecin (Physician Global Assessment) de ≥ 3 au moment de la demande initiale de remboursement.
• La durée maximale de l’autorisation initiale est de six mois.
Critères de renouvellement :
• Les demandes de renouvellement doivent fournir la preuve de l’effet clinique bénéfique caractérisé par une amélioration de 75 % ou plus du score de l’indice d’étendue et de gravité de l’eczéma (Eczema Area and Severity Index, EASI-75) par rapport à la référence six mois après l’instauration du traitement.
• La preuve du maintien de la réponse EASI-75 par rapport à la référence doit être fournie pour les autorisations ultérieures.
Notes cliniques :
• Le patient doit être pris en charge par un dermatologue.
• Dupilumab ne doit pas être utilisé en association avec la photothérapie ou les immunosuppresseurs (p. ex., méthotrexate, cyclosporine).
• Les approbations porteront sur un maximum de 600 mg à la semaine 0, puis 300 mg toutes les deux semaines par la suite
Admissibilité au programme : Programme de médicaments à coût élevé
Critères de couverture de DUPIXENT® sur le formulaire de Nouvelle-Écosse (statut de médicament d’exception)25
Pour l’approbation, les prescripteurs autorisés devront remplir un formulaire de demande de statut de médicament d’exception.
Pour le traitement de la dermatite atopique modérée à sévère chez les patients âgés de 12 ans et plus, qui satisfont à tous les critères suivants :
• Réfractaires ou présentant des contre-indications à un essai adéquat de traitements topiques sur ordonnance.
• Réfractaires, intolérants ou présentant des contre-indications à un essai adéquat de photothérapie (le cas échéant), de méthotrexate et de cyclosporine.
• Score de référence de l’évaluation globale du médecin égal ou supérieur à 3 et score d’étendue et de gravité de l’eczéma égal ou supérieur à 7,1.
Critères de renouvellement :
• Les demandes de renouvellement doivent fournir la preuve de l’effet clinique bénéfique caractérisé par une amélioration de 75 % ou plus du score de l’indice d’étendue et de gravité de l’eczéma (Eczema Area and Severity Index, EASI-75) par rapport à la référence six mois après l’instauration du traitement.
• La preuve du maintien de la réponse EASI-75 par rapport à la référence doit être fournie pour les autorisations ultérieures.
Notes cliniques :
• Ne pas utiliser en association avec la photothérapie ou les immunosuppresseurs (p. ex., méthotrexate, cyclosporine).
Notes de réclamation :
• Le patient doit être pris en charge par un dermatologue ou un allergologue.
• Les approbations porteront sur un maximum de 600 mg à la semaine 0, puis 300 mg toutes les deux semaines par la suite.
• Période d’approbation initiale : 6 mois.
• Période d’approbation du renouvellement : 1 an.
Critères de couverture de DUPIXENT® dans les Territoires du Nord-Ouest en vertu du programme d’extension des prestations de santé pour des maladies spécifiques (avantage à usage limité, critères correspondant à SSNA)24,27
Pour l’approbation, les prescripteurs autorisés devront remplir un formulaire de demande du programme d’extension des prestations de santé.
Les critères correspondent aux SSNA
Critères de couverture des SSNA/Remarques thérapeutiques
Avantage à usage limité (approbation préalable requise).
Critères de couverture initiaux (4 mois) :
Pour les patients âgés de 12 ans et plus atteints de dermatite atopique chronique modérée- à- sévère qui répondent à tous les critères suivants :
• le patient ou la patiente présente un score égal ou supérieur à 16 sur l’Indice de surface et de gravité de l’eczéma (EASI, Eczema Area and Severity Index); et
• le patient ou la patiente présente un score supérieur ou égal à 8 sur l’indice dermatologique de la qualité de vie (DLQI, pour Dermatology Life Quality Index) ou sur l’indice dermatologique pédiatrique de la qualité de vie (Children’s Dermatology Life Quality Index, CDLQI); et
• la surface corporelle (SC) atteinte est d’au moins 10 %; et
• la maladie est insuffisamment contrôlée malgré l’utilisation de traitements topiques comprenant au moins deux corticostéroïdes topiques de puissance moyenne ou élevée et un inhibiteur topique de la calcineurine; et
• Intolérance ou absence de réponse à la photothérapie ou aucun accès à la photothérapie.
Critères de renouvellement ou de couverture initiale chez les patients actuellement maintenus sous DUPIXENT® (12 mois) :
• le patient ou la patiente constate une amélioration d’au moins 75 % du score EASI par rapport au niveau de référence; ou
• le patient ou la patiente constate une amélioration d’au moins 50 % du score EASI; et
• le patient ou la patiente a présenté une diminution d’au moins cinq points au questionnaire DLQI ou CDLQI par rapport à la référence.
Les autorisations pour le dupilumab sont données à raison d’une dose initiale maximale de 600 mg suivie d’une dose maximale de 300 mg toutes les 2 semaines.
Critères de couverture de DUPIXENT® par les régimes d’assurance-médicaments du Nouveau-Brunswick (autorisation spéciale)28
Pour demander une couverture en vertu d’une autorisation spéciale, les prescripteurs autorisés devront remplir un formulaire.
Pour le traitement de la dermatite atopique modérée à sévère chez les patients âgés de 12 ans et plus, qui satisfont à tous les critères suivants :
• Réfractaires ou présentant des contre-indications à un essai adéquat de traitements topiques sur ordonnance
• Réfractaire, intolérant ou présentant des contre-indications à la photothérapie (le cas échéant), méthotrexate et cyclosporine, et
• Score de référence de l’évaluation globale du médecin égal ou supérieur à 3 et score d’étendue et de gravité de l’eczéma égal ou supérieur à 7,1
Critères de renouvellement
• Les demandes de renouvellement doivent fournir la preuve de l’effet clinique bénéfique caractérisé par une amélioration de 75 % ou plus du score de l’indice d’étendue et de gravité de l’eczéma (Eczema Area and Severity Index, EASI-75) par rapport à la référence six mois après l’instauration du traitement.
• La preuve du maintien de la réponse EASI-75 par rapport à la référence doit être fournie pour les autorisations ultérieures.
Notes cliniques :
• Ne pas utiliser en association avec la photothérapie ou les immunosuppresseurs (p. ex., méthotrexate, cyclosporine).
Notes de réclamation :
• Ce produit doit être prescrit par un dermatologue.
• Les approbations porteront sur un maximum de 600 mg à la semaine 0, puis 300 mg toutes les deux semaines par la suite.
• Période d’approbation initiale : 6 mois.
• Période d’approbation du renouvellement : 1 an.
Les logos de DUPIXENT®, de Sanofi et de Liberté sont des marques déposées de Sanofi, utilisées sous licence par sanofi-aventis Canada inc.
REGENERON® est une marque déposée de Regeneron Pharmaceuticals, Inc. Tous droits réservés.
© 2023 sanofi-aventis Canada inc. Tous droits réservés.
MAT-CA-2300298F
Dernière révision : 06/2023