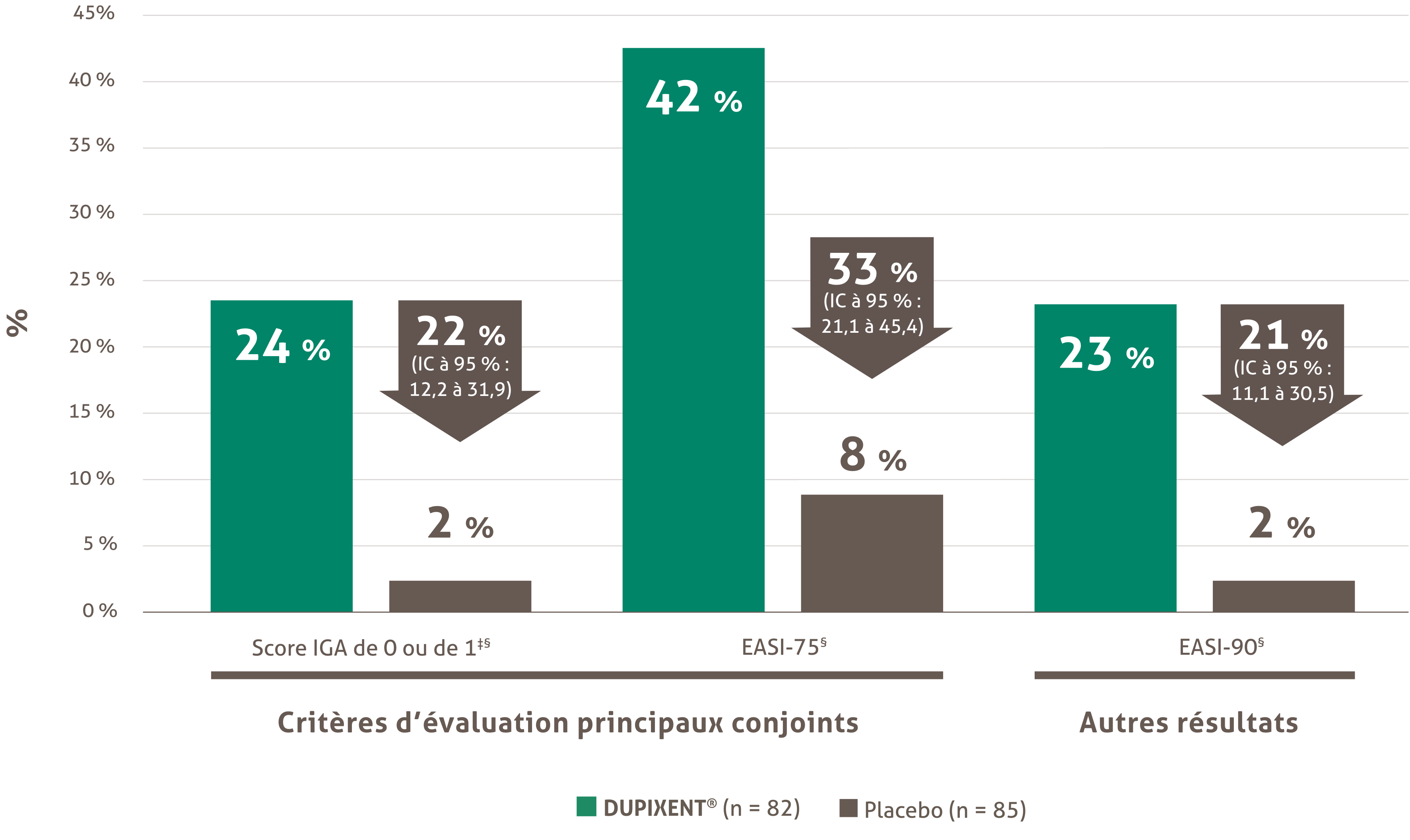
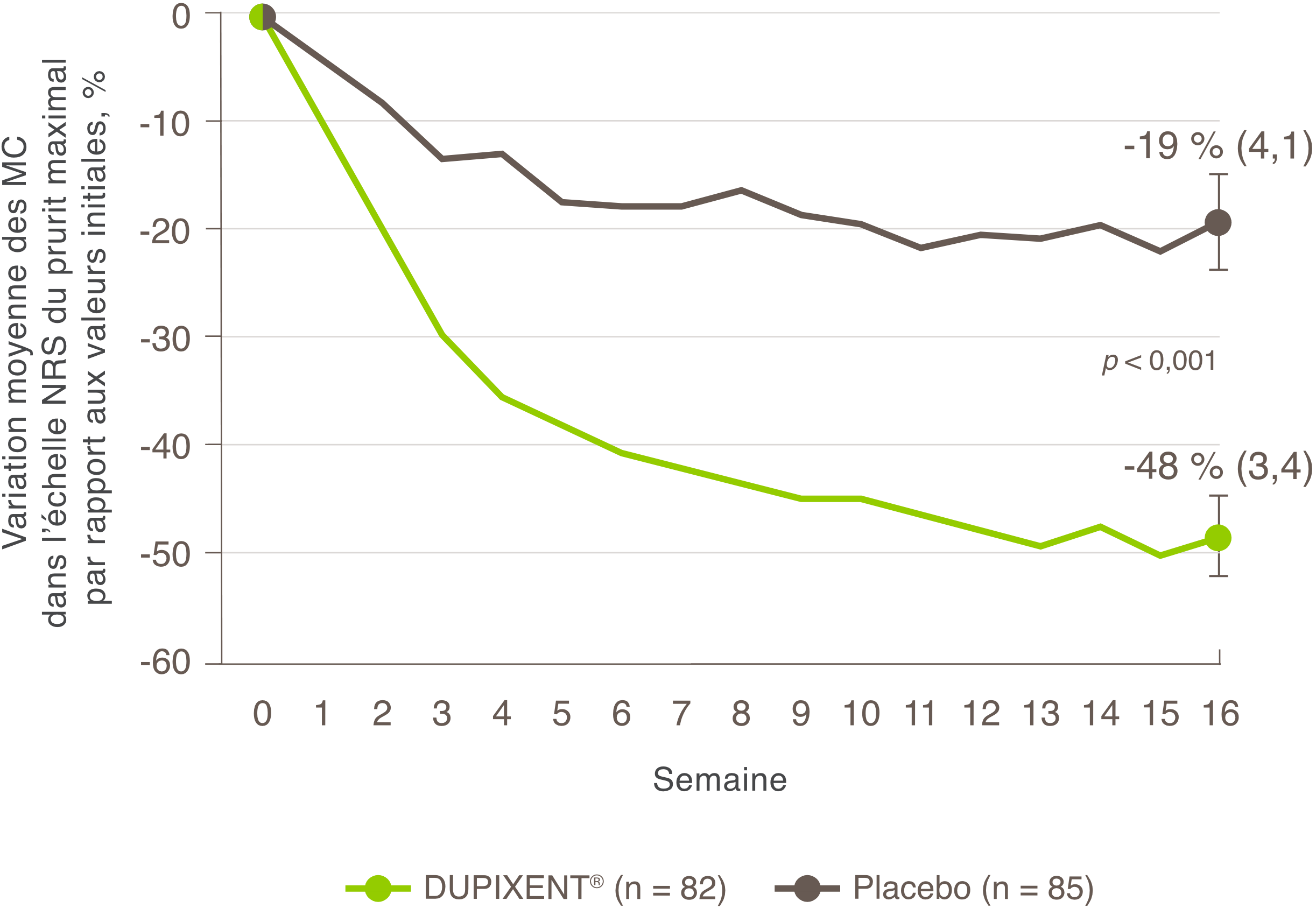
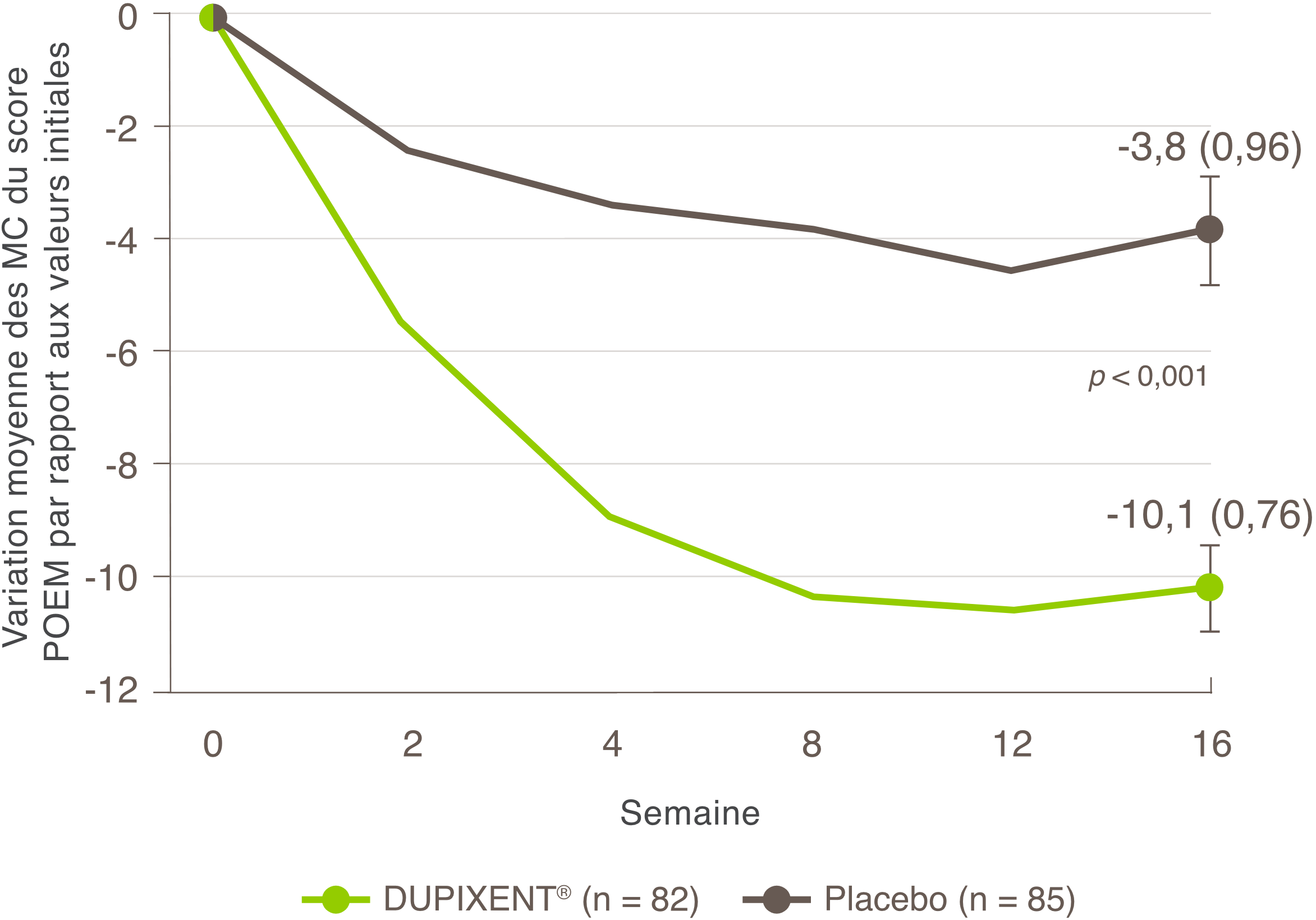
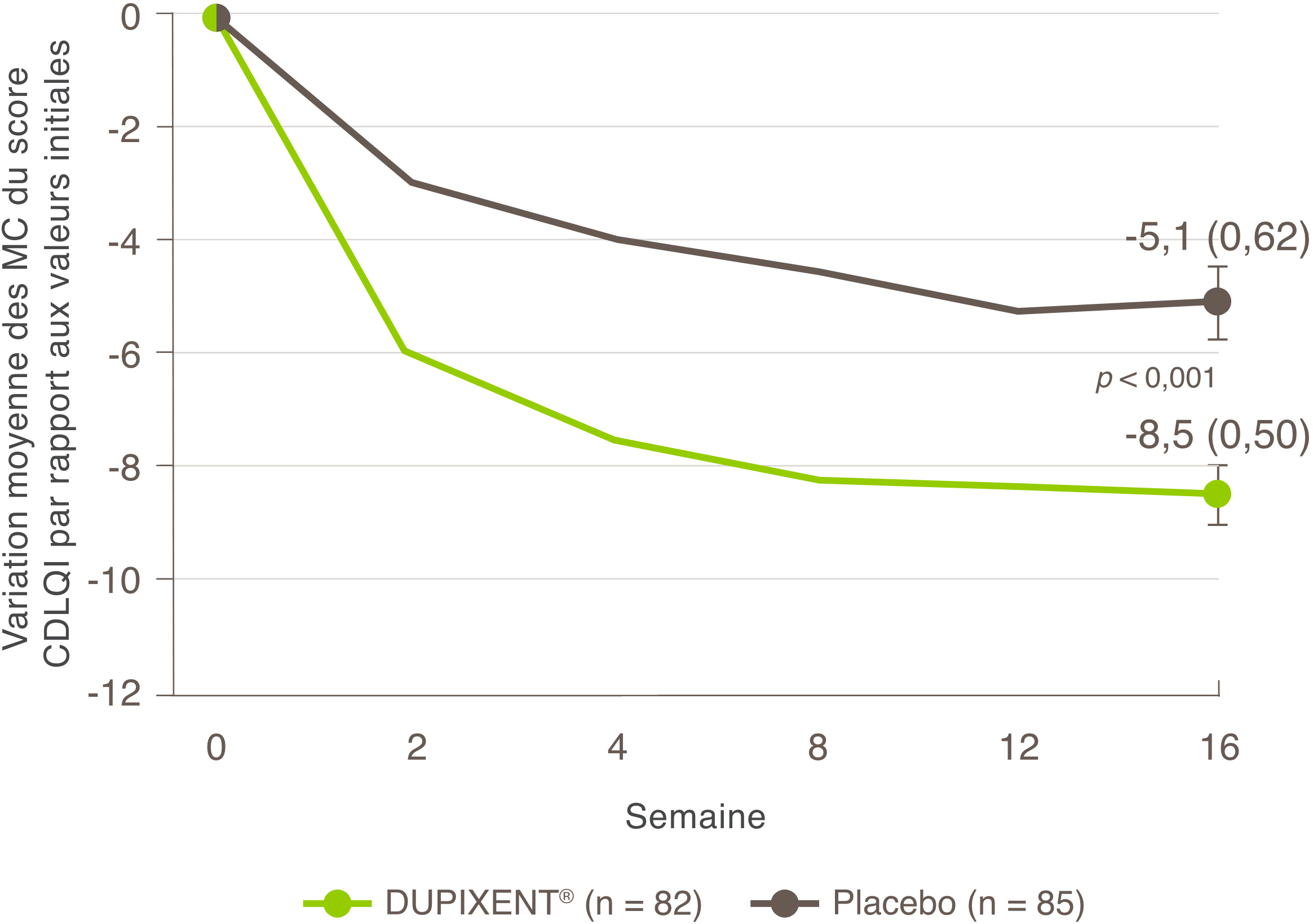
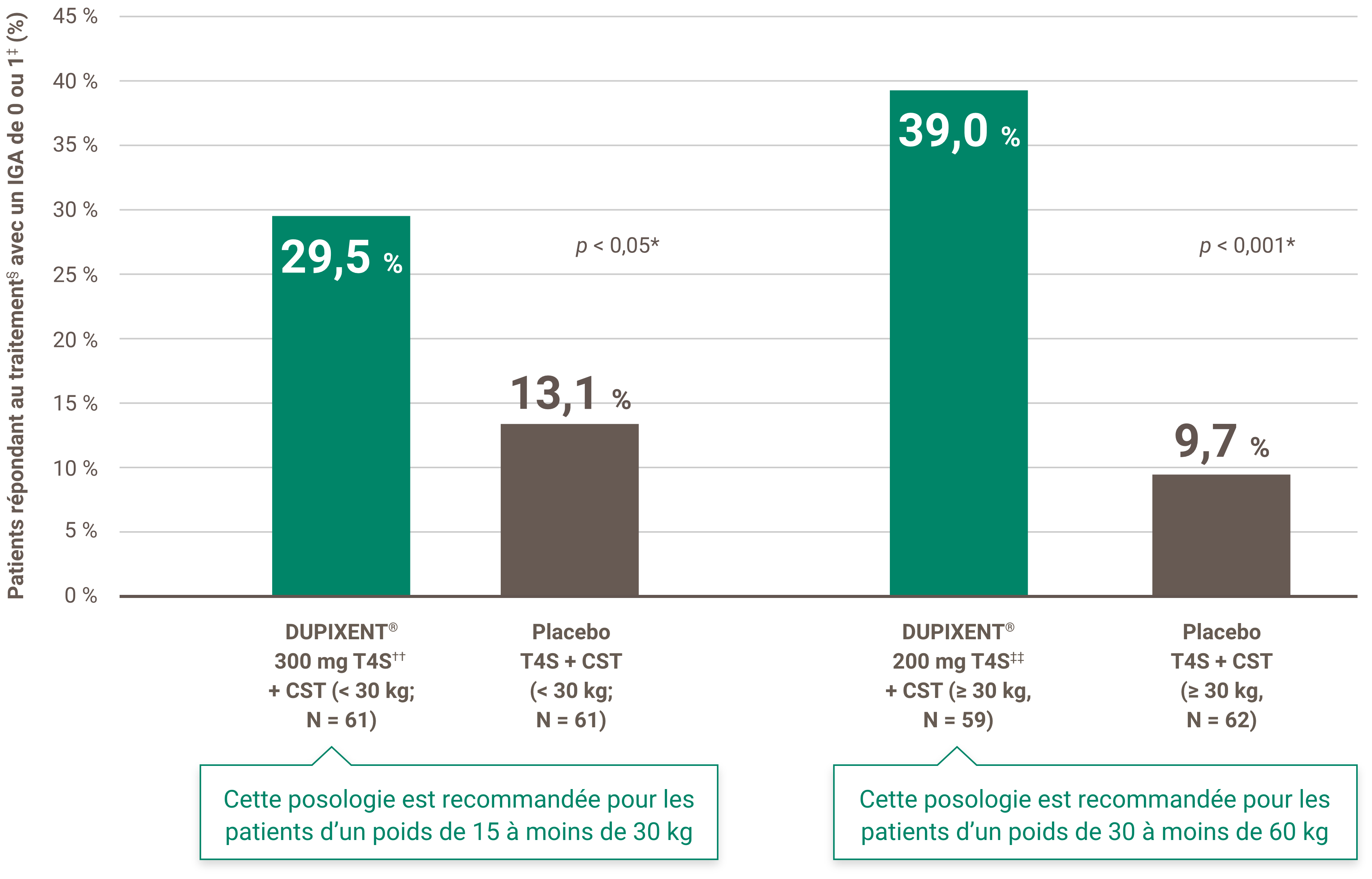
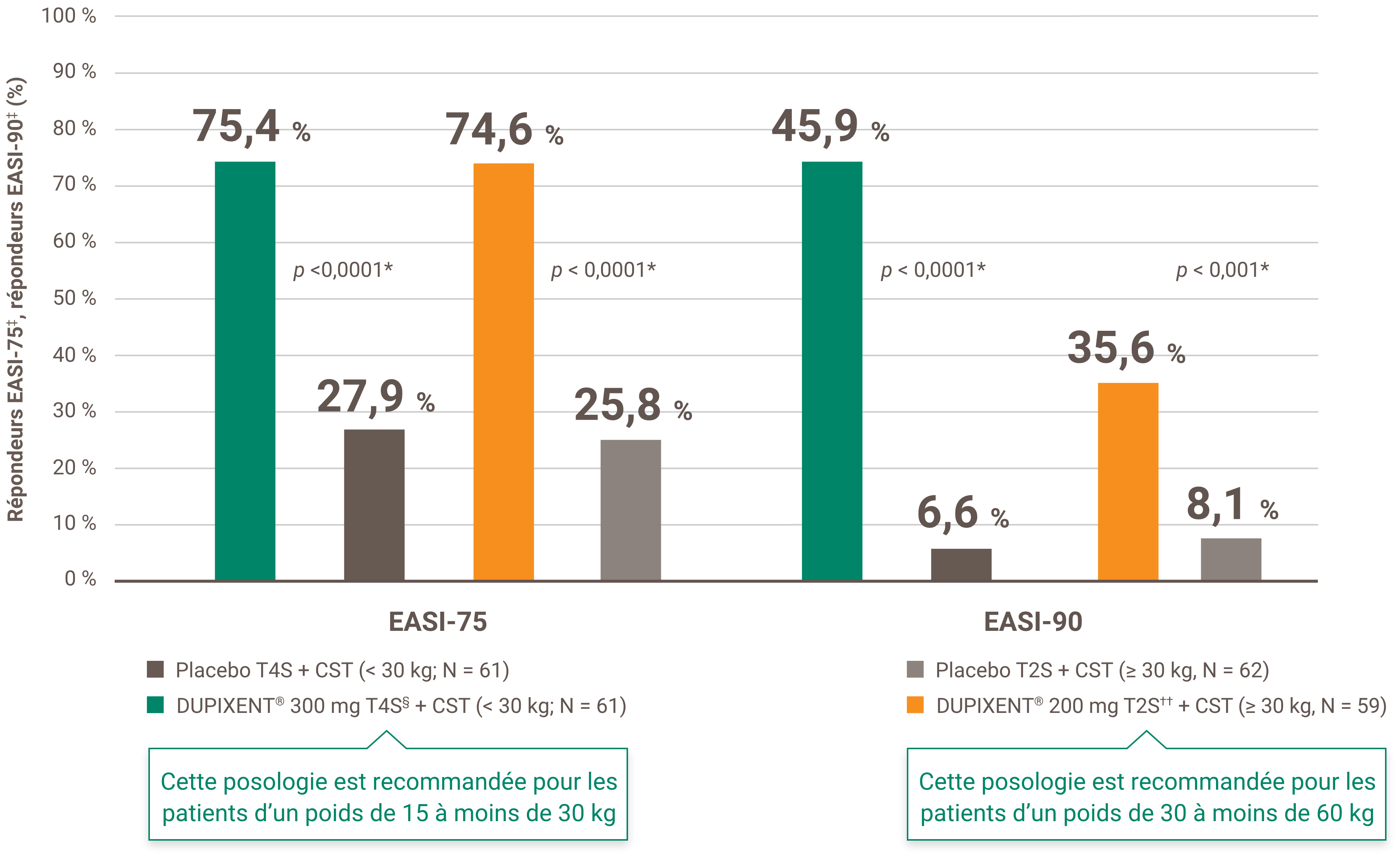
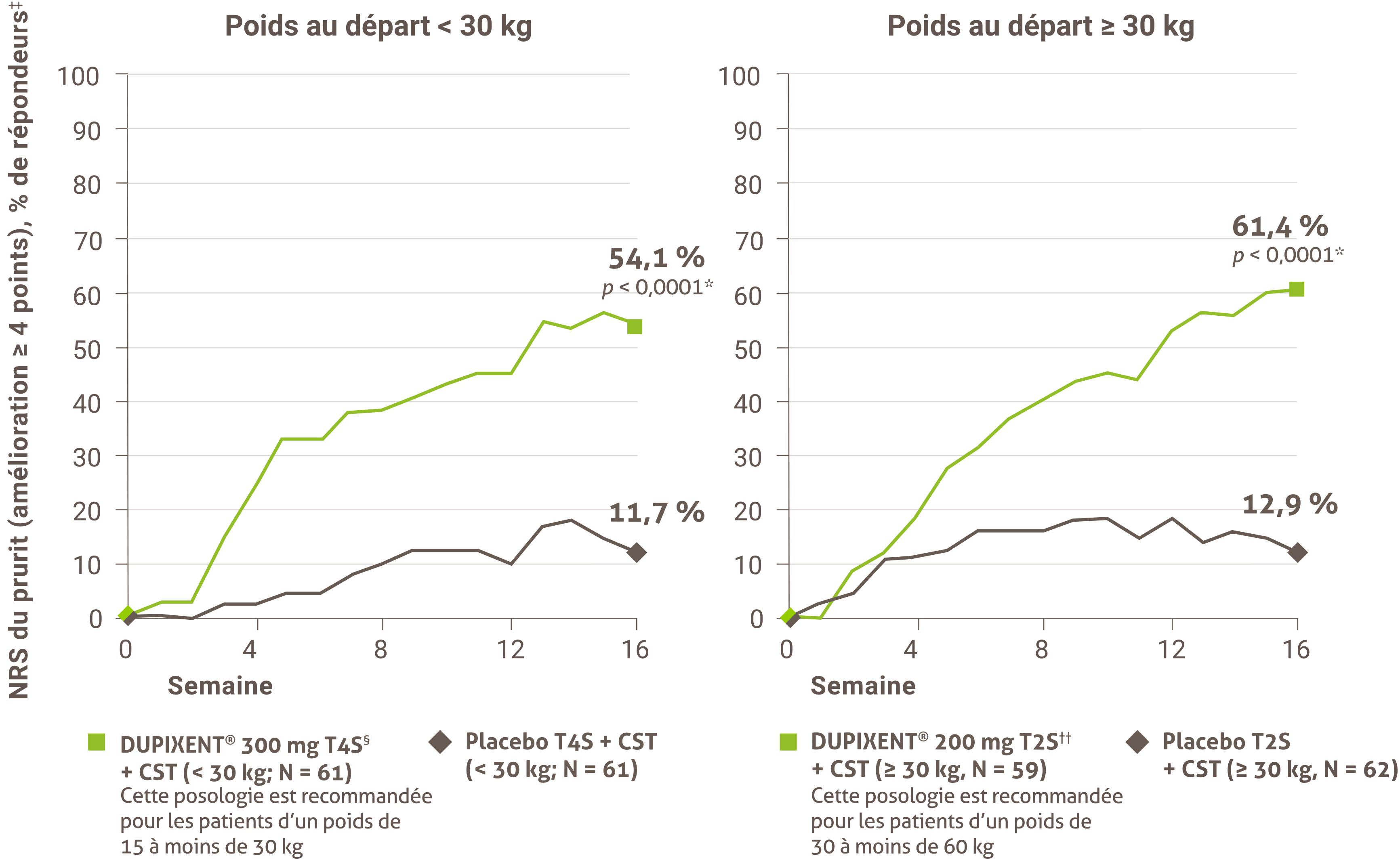
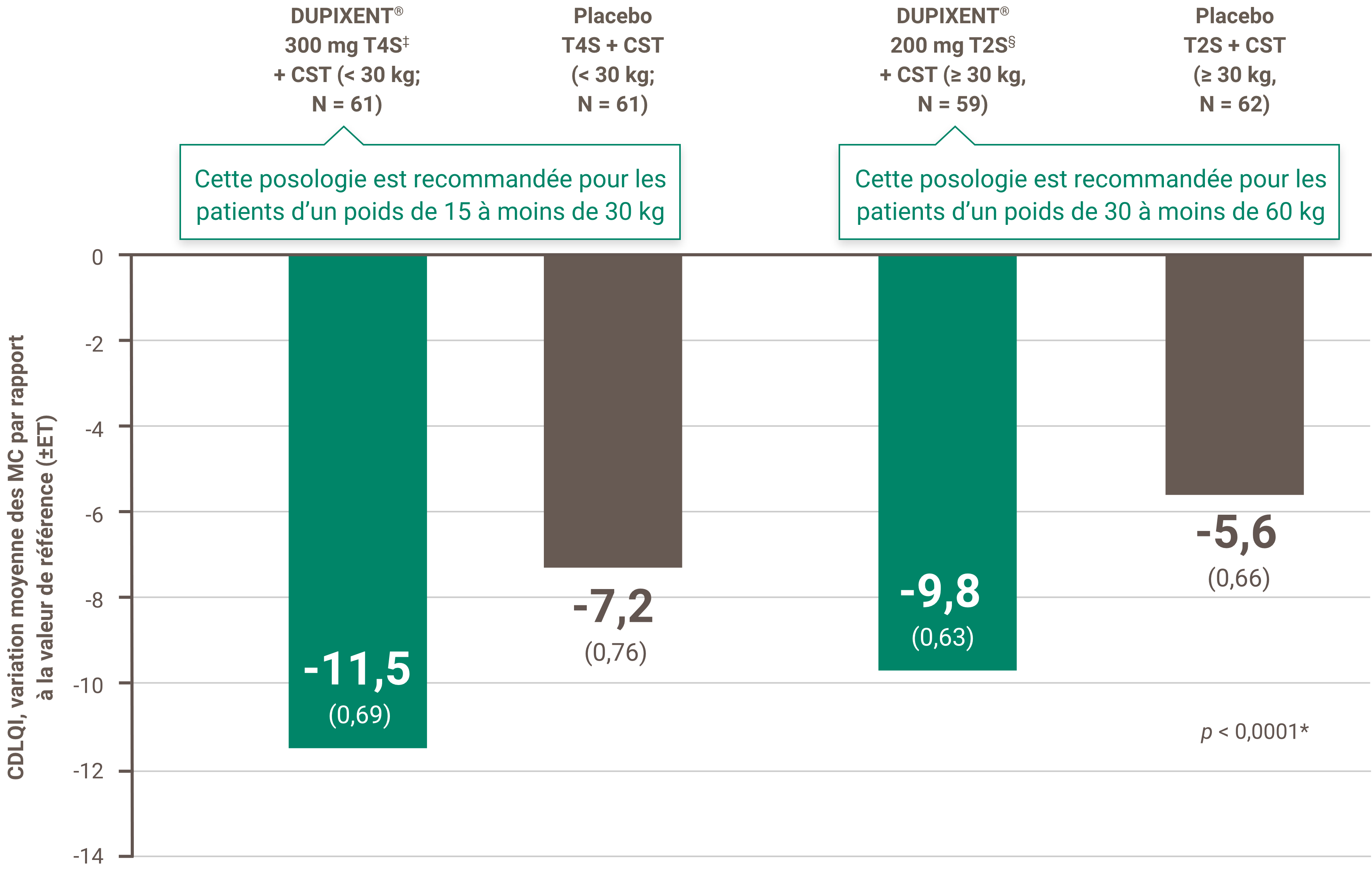
Indications et usage clinique :
Dermatite atopique
DUPIXENT® (dupilumab injectable) est indiqué pour le traitement des patients âgés de 6 ans et plus atteints de dermatite atopique modérée à sévère dont la maladie n’est pas contrôlée de manière adéquate par des traitements topiques sous ordonnance ou lorsque ces traitements ne sont pas recommandés.
DUPIXENT® peut être utilisé avec ou sans corticostéroïdes topiques.
• Aucun ajustement de la dose n’est recommandé chez les patients âgés
• L’innocuité et l’efficacité de DUPIXENT® n’ont pas été établies chez les patients pédiatriques atteints de dermatite atopique qui sont âgés de moins de 6 ans
Asthme
DUPIXENT® (dupilumab injectable) est indiqué en traitement d’entretien d’appoint chez les patients âgés de 6 ans et plus atteints d’asthme sévère de type 2/de phénotype éosinophilique ou nécessitant une corticothérapie orale.
DUPIXENT® n’est pas indiqué pour le soulagement du bronchospasme aigu ou de l’état de mal asthmatique.
• L’innocuité et l’efficacité du produit n’ont pas été établies chez les patients pédiatriques atteints d’asthme qui sont âgés de moins de 6 ans
Rhinosinusite chronique sévère avec polypes nasaux
DUPIXENT® (dupilumab injectable) est indiqué, en association avec des corticostéroïdes administrés par voie intranasale, pour le traitement d’entretien d’appoint des patients adultes atteints d’une rhinosinusite chronique grave avec polypose nasale (RSC-PN) qui n’est pas adéquatement maîtrisée par des corticostéroïdes à action générale et/ou une intervention chirurgicale.
• Aucun ajustement de la dose n’est recommandé chez les patients âgés.
• L’innocuité et l’efficacité de DUPIXENT® n’ont pas été établies chez les patients pédiatriques atteints de RSC-PN
Contre-indications :
Hypersensibilité à DUPIXENT® ou à l’un des ingrédients de la formulation de ce médicament ou des composants du récipient.
Mises en garde et précautions :
• Réduction de la dose de corticostéroïdes
• Réactions d’hypersensibilité générale
• Augmentation du nombre d’éosinophiles dans le sang
• Pneumonie éosinophilique
• Non étudié en association avec des vaccins vivants
• Conjonctivite et kératite
• Patients atteints d’une infection causée par des helminthes
• Patients atteints d’affections atopiques concomitantes
• Symptômes d’asthme aigu ou aggravation de la maladie
• Femmes enceintes et qui allaitent
Pour de plus amples renseignements :
Consultez la monographie de produit à l’adresse http://products.sanofi.ca/fr/DUPIXENT-fr.pdf pour obtenir des renseignements importants qui n’ont pas été discutés dans ce document en ce qui concerne les effets indésirables du médicament, les interactions médicamenteuses et la posologie. La monographie de produit peut aussi être obtenue en téléphonant au 1 800 589-6215.
Références
1. Monographie de DUPIXENT®, sanofi-aventis Canada inc., 25 mars 2022.
2. Johnston A, et al. Immunobiologics: Targeted Therapy Against Cytokines, Cytokine Receptors, and Growth Factors in Dermatology. Fitzpatrick’s Dermatology, 9e. New York, NY: McGraw-Hill. Disponible à l’adresse : http://accessmedicine.mhmedical.com/content.aspx?bookid=2570§ionid=210444001. Consulté le 19 août 2019.
3. Simpson EL, et al. NEJM 2016;375:2335-48.
4. Paller et al. J Am Acad Dermatol 2020; https://doi.org/10.1016/j.jaad.2020.06.054.
5. Blauvelt A, et al. Lancet. 2017;389:2287–2303.
6. Données internes, sanofi-aventis Canada inc.
7. Phan NQ, et al. Acta Derm Venereol 2012;92(5):449-581.
8. Données internes, sanofi-aventis Canada inc.
9. International Eczema Council. Investigator Global Assessment Scale. Disponible à l’adresse : http://www.eczemacouncil.org/research/investigator-global-assessment-scale/. Consulté le 19 août 2019.
10. Harmonising Outcome Measures for Eczema (HOME). EASI Scoring System. January 2017. Disponible à l’adresse : http://www.homeforeczema.org/documents/easi-user-guide-jan-2017-v3.pdf. Consulté le 4 mars 2019.
11. Pruritus Resources. Numerical Rating Scale (NRS). Disponible à l’adresse : http://www.pruritussymposium.de/numericalratingscale.html. Consulté le 24 mai 2018.
12. Finlay AY and Khan GK. Clin Exp Dermatol 1994;19(3):210-6.
13. Cardiff University School of Medicine – Department of Dermatology. DLQI Instructions for use and scoring. Disponible à l’adresse : http://sites.cardiff.ac.uk/dermatology/quality-of-life/dermatology-quality-of-life-index-dlqi/dlqi-instructions-for-use-and-scoring/. Consulté le 10 mai 2018.
14. Charman C, et al. Arch Dermatol 2004;140:1513-19.
15. University of Nottingham – Centre of Evidence Based Dermatology. POEM – Patient Oriented Eczema Measure. Disponible à l’adresse : https://www.nottingham.ac.uk/research/groups/cebd/resources/poem.aspx. Consulté le 25 mai 2018.
16. Simpson EL, et al. JAMA Dermatol 2019; doi : 10.1001/jamadermatol.2019.3336.
17. Lewis-Jones MS, Finlay AY. Br J Dermatol 1995;132(6):942-9.
18. Paller et al. J Am Acad Dermatol 2020; https://doi.org/10.1016/j.jaad.2020.06.054.
19. Saskatchewan Formulary Bulletin. Bulletin no 200. 1er juin 2021. Mise à jour de la 62e édition de la liste des médicaments admissibles en Saskatchewan. Consulté le 26 avril 2023. Disponible à l’adresse : https://formulary.drugplan.ehealthsask.ca/Bulletins/Bulletin-0200-Jun-2021.pdf.
20. Manitoba Drug Benefits and Interchangeability Formulary Amendments. Bulletin no 112. Consulté le 26 avril 2023. Disponible à l’adresse : https://www.gov.mb.ca/health/mdbif/docs/bulletins/bulletin112.pdf.
21. Ministère de la Santé de l’Ontario. Exceptional Access Program Reimbursement Criteria for Frequently Requested Drugs. Consulté le 26 avril 2023. Disponible à l’adresse : https://www.health.gov.on.ca/en/pro/programs/drugs/docs/frequently_requested_drugs.pdf
22. Liste des médicaments de la RAMQ. Mise à jour le 13 avril 2023. Consulté le 26 avril 2023. Disponible à l’adresse : https://www.ramq.gouv.qc.ca/fr/a-propos/liste-medicaments.
23. Mise à jour de la liste de médicaments du régime du Nouveau-Brunswick. Publié le 13 mai 2021. Consulté le 26 avril 2023. Disponible à l’adresse : https://www2.gnb.ca/content/dam/gnb/Departments/h-s/pdf/en/NBDrugPlan/FormularyUpdates/NBDrugPlansBulletin-1053.pdf
24. Programme des services de santé non assurés de la Direction générale de la santé des Premières nations et des Inuits. Liste des médicaments. Consulté le 26 avril 2023. Disponible à l’adresse : https://nihb.express-scripts.ca/NIHBProvider/benefits/pharmacy?page=drugbenefit-grid&benefit=pharmacy
25. Liste de médicaments de la Nouvelle-Écosse. Consulté le 26 avril 2023. Disponible à l’adresse : https://novascotia.ca/dhw/pharmacare/documents/formulary.pdf.
26. Liste Pharmacare de l’IPE. Consulté le 26 avril 2023. Disponible à l’adresse : https://www.princeedwardisland.ca/sites/default/files/publications/pei_pharmacare_formulary.pdf.
27. Gouvernement des Territoires du Nord-Ouest. Programmes d’extension des prestations de santé pour des maladies spécifiques. Consulté le 3 décembre 2021. Disponible à l’adresse : https://www.hss.gov.nt.ca/en/services/supplementary-health-benefits/extended-health-benefits-specified-disease-conditions.
28. Programme de médicaments sur ordonnance de Terre-Neuve-et-Labrador. Special Authorization Drug Products. Mis à jour le 19 avril 2023. Consulté le 26 avril 2023. Disponible à l’adresse : https://www.gov.nl.ca/hcs/prescription/covered-specialauthdrugs/. Bulletin No 5. Mise à jour de la liste des avantages. Consulté le 18 janvier 2022. Disponible à l’adresse : https://nlpdp.bell.ca/.
29. Saeki H, Nakahara T, et al. Journal of Dermatology 2016;43:1117–1145.
30. Balkrishnan R, et al. Arch Dis Child. 2003;88(5):423-7.
31. Société canadienne de l’eczéma. Atopic Dermatitis : A Practical Guide to Management. Disponible à l’adresse : https://eczemahelp.ca/wp-content/uploads/2019/03/ESC_AD_Practical-Guide-to-Management-for-HCP_2019.pdf. Consulté le 27 janvier 2020.
Les logos de DUPIXENT®, de Sanofi et de Liberté sont des marques déposées de Sanofi, utilisées sous licence par sanofi-aventis Canada inc.
REGENERON® est une marque déposée de Regeneron Pharmaceuticals, Inc. Tous droits réservés.
© 2023 sanofi-aventis Canada inc. Tous droits réservés.
MAT-CA-2300298F
Dernière révision : 06/2023