Questions sur le DUPIXENT®
Vous avez une question concernant le DUPIXENT®? Consultez la FAQ plus bas. Si vous ne trouvez pas réponses à vos questions, demandez à un(e) représentant(e) ou contactez-nous.
Éléments fondamentaux du DUPIXENT®
La réduction des démangeaisons était un des principaux critères d'évaluation secondaires dans trois essais à répartition aléatoire à double insu et contrôlé par placebo totalisant 2 119 sujets de 18 ans et plus atteints de dermatite atopique modérée à sévère qui n’est pas adéquatement contrôlée par des médicaments topiques.1 Cliquez ici pour obtenir des renseignements supplémentaires concernant la conception des essais cliniques.
La réduction des démangeaisons avec DUPIXENT® a été rapide et soutenue.
Un soulagement significatif du prurit avec le DUPIXENT® comparativement au placebo a été constaté dès la semaine 2 (p < 0,01) lors des deux essais en monothérapie pivots, ainsi qu’une réduction significative des démangeaisons à la semaine 16.1,3
• 41 % des patients ont affiché une amélioration de ≥ 4 points sur l’échelle NRS du prurit avec le DUPIXENT® à la semaine 16 de l’essai SOLO 1 vs 12 % avec le placebo.1
• 36 % des patients ont affiché une amélioration de ≥ 4 points l’échelle NRS du prurit avec le DUPIXENT® à la semaine 16 de l’essai SOLO 2 vs 10 % avec le placebo.1
• 9,4 % des patients ont affiché une amélioration de ≥ 4 points sur l'échelle NRS du prurit avec le DUPIXENT® à la semaine 2 de l’essai SOLO 1 vs 3,3 % avec le placebo.1
• 10,7 % des patients ont affiché une amélioration de ≥ 4 points sur l'échelle NRS du prurit avec le DUPIXENT® à la semaine 2 de l’essai SOLO 2 vs 0,9 % avec le placebo.1
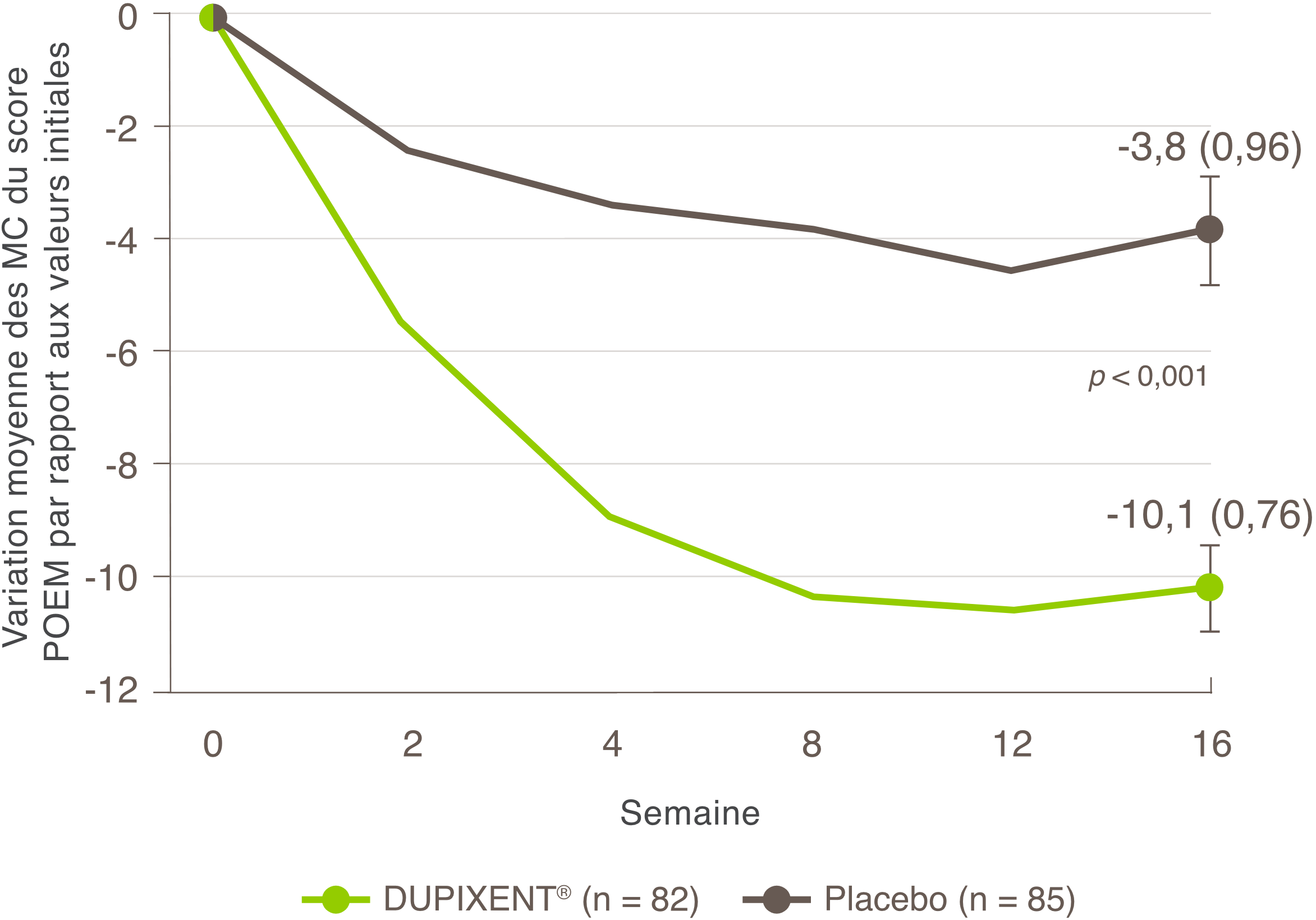
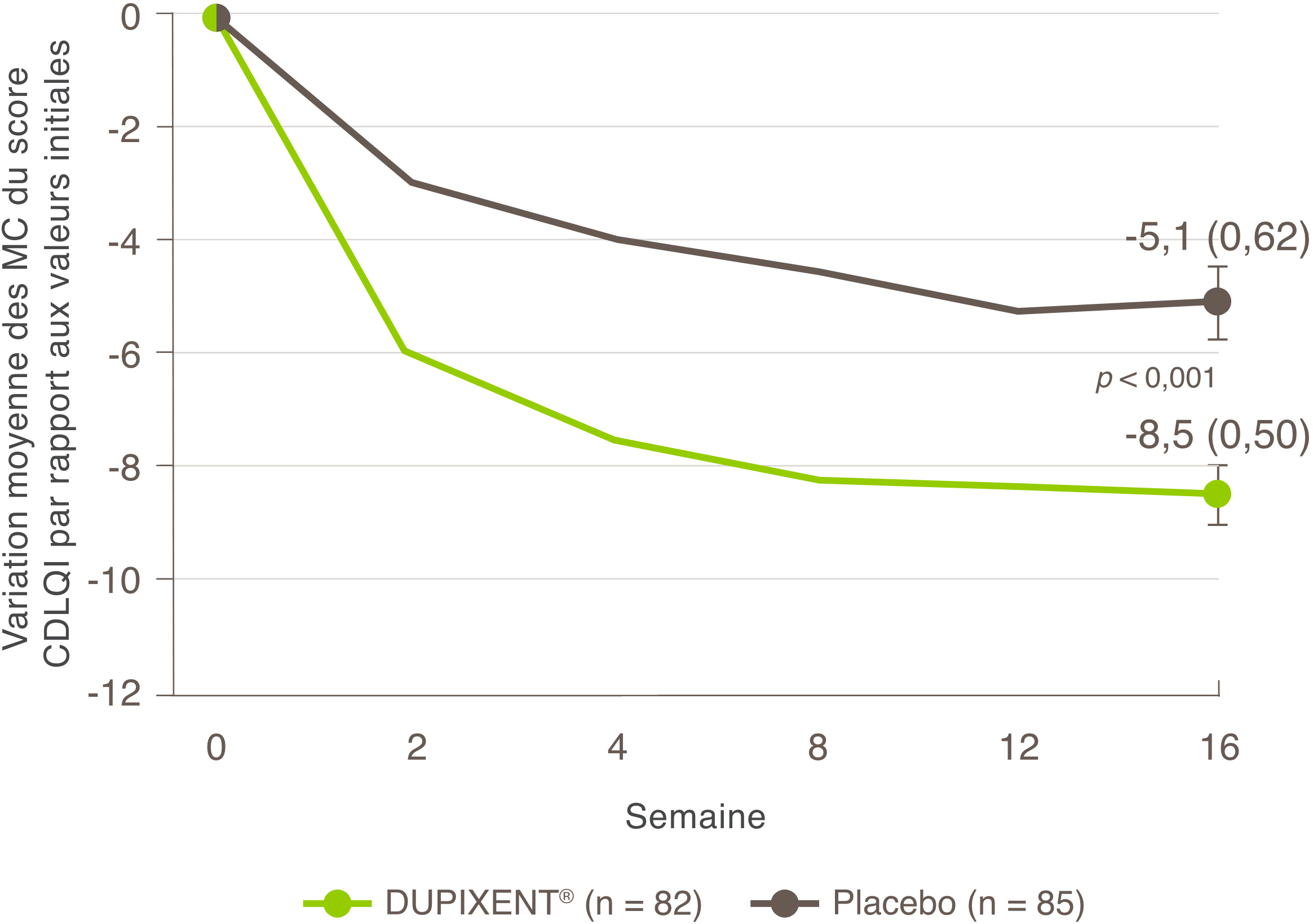
La réduction des démangeaisons était l’un des principaux critères d’évaluation secondaires lors d’un essai multicentrique, à répartition aléatoire, à double insu et contrôlé par placebo visant à évaluer l’efficacité et l’innocuité de DUPIXENT® en monothérapie sur 16 semaines chez 251 patients adolescents (12 à 17 ans) atteints de DA modérée à sévère dont la maladie n’était pas adéquatement contrôlée par des médicaments topiques1. Cliquez ici pour obtenir des renseignements supplémentaires concernant la conception des essais cliniques.
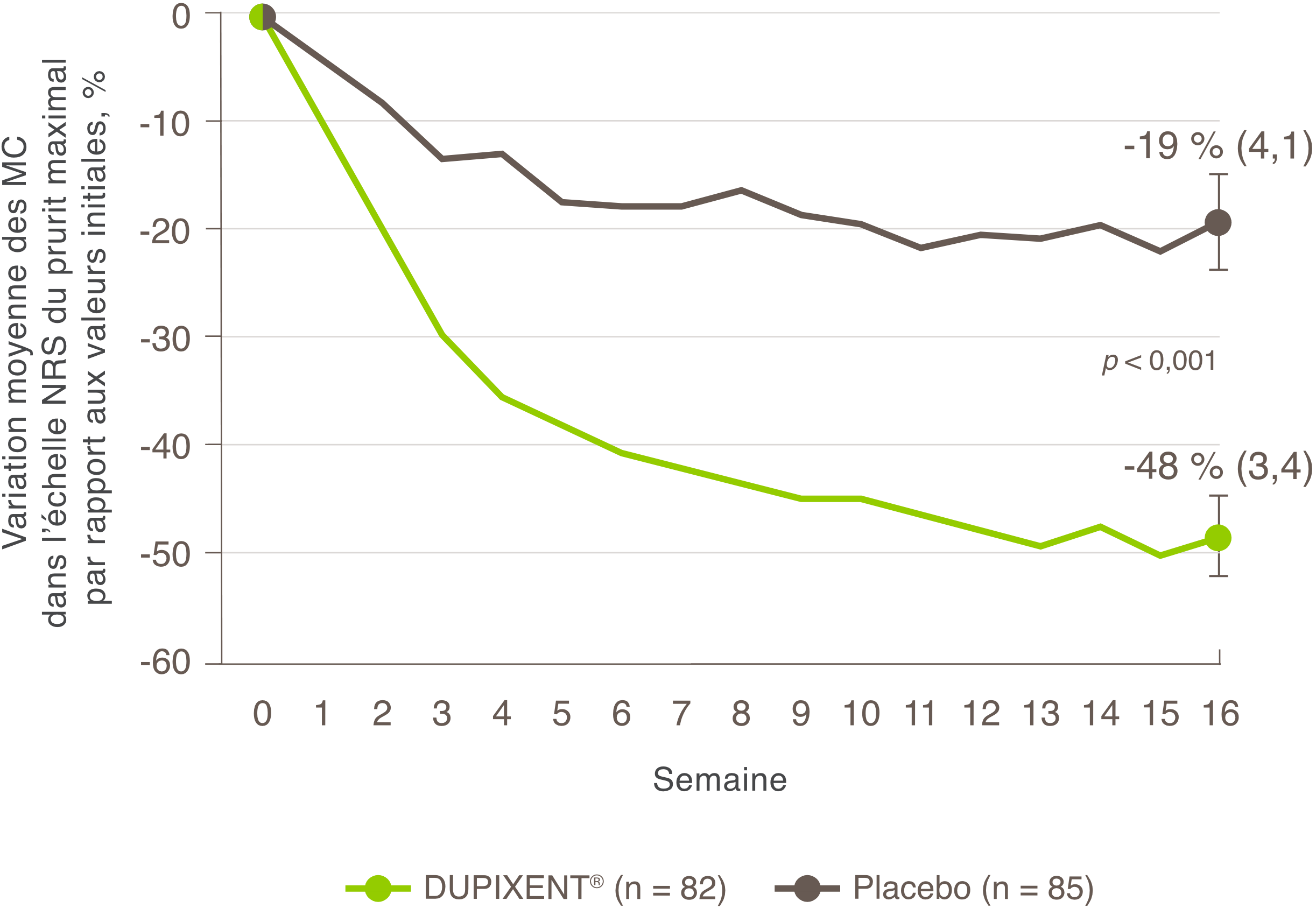
Une réduction significative des démangeaisons a été observée à la semaine 16.1
• 37 % des patients ont affiché une amélioration de ≥ 4 points sur l’échelle d’évaluation numérique (numerical rating scale, NRS) du prurit avec DUPIXENT® à la semaine 16 par rapport à 5 % avec le placebo1†
• Une amélioration moyenne de 48 % sur l’échelle NRS du prurit a été observée avec DUPIXENT® à la semaine 16 par rapport à 19 % avec le placebo1
Une proportion nettement plus élevée de sujets répartis aléatoirement dans le groupe DUPIXENT® a obtenu une amélioration rapide selon l’échelle NRS du prurit comparé au placebo (caractérisée par une amélioration de > 4 points dès la semaine 4; p nominale < 0,001).1
La proportion de sujets réagissant favorablement au traitement selon l’échelle NRS du prurit a continué à augmenter tout au long de la période de traitement. L’amélioration obtenue à l’échelle NRS du prurit s’accompagnait d’atténuations des signes objectifs de dermatite atopique.1
† Les sujets ayant pris un médicament de secours ou pour lesquels il manquait certaines données étaient considérés comme des non-répondants (59 % et 21 % des sujets du groupe placebo et du groupe DUPIXENT®, respectivement).1
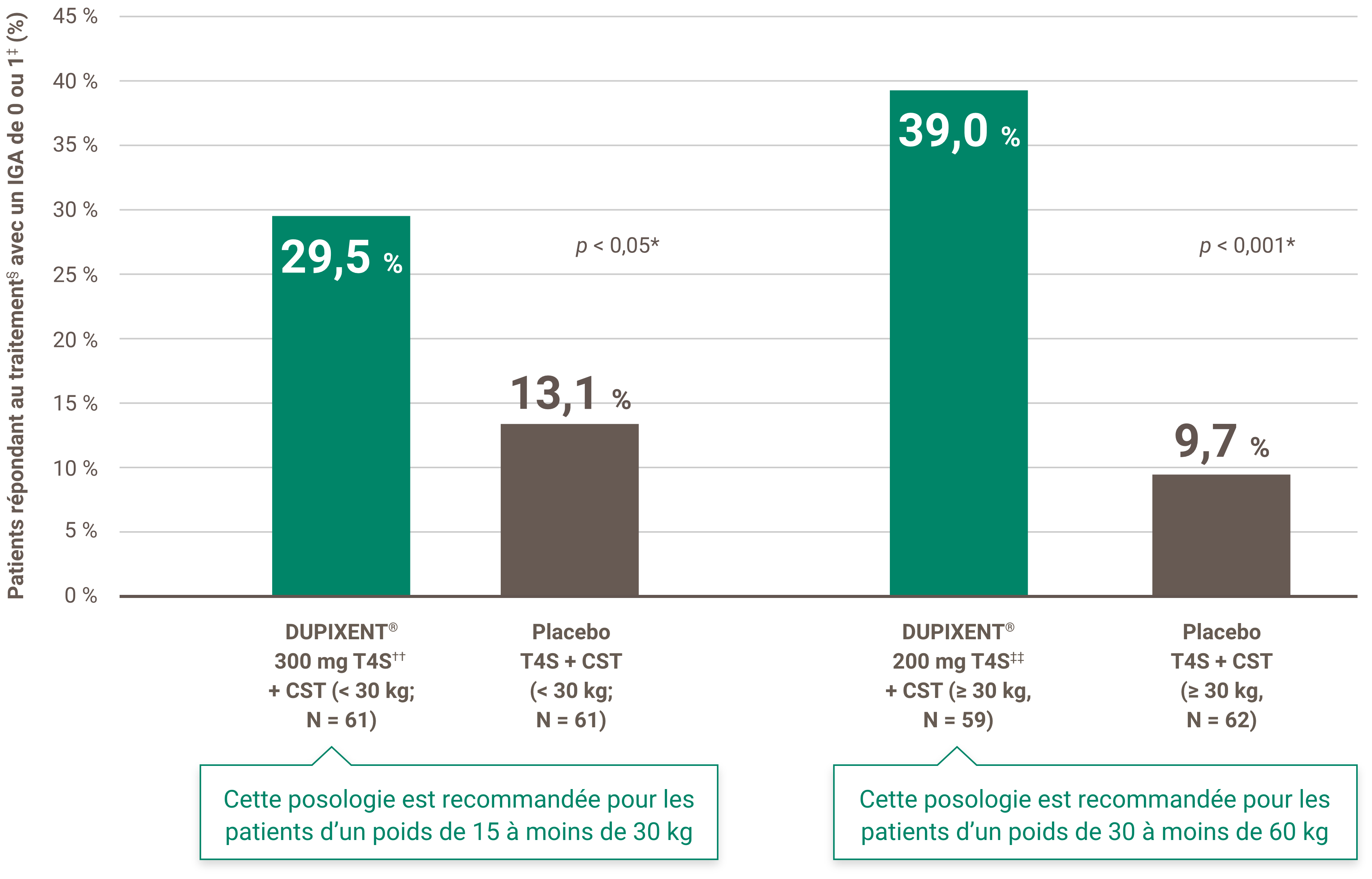
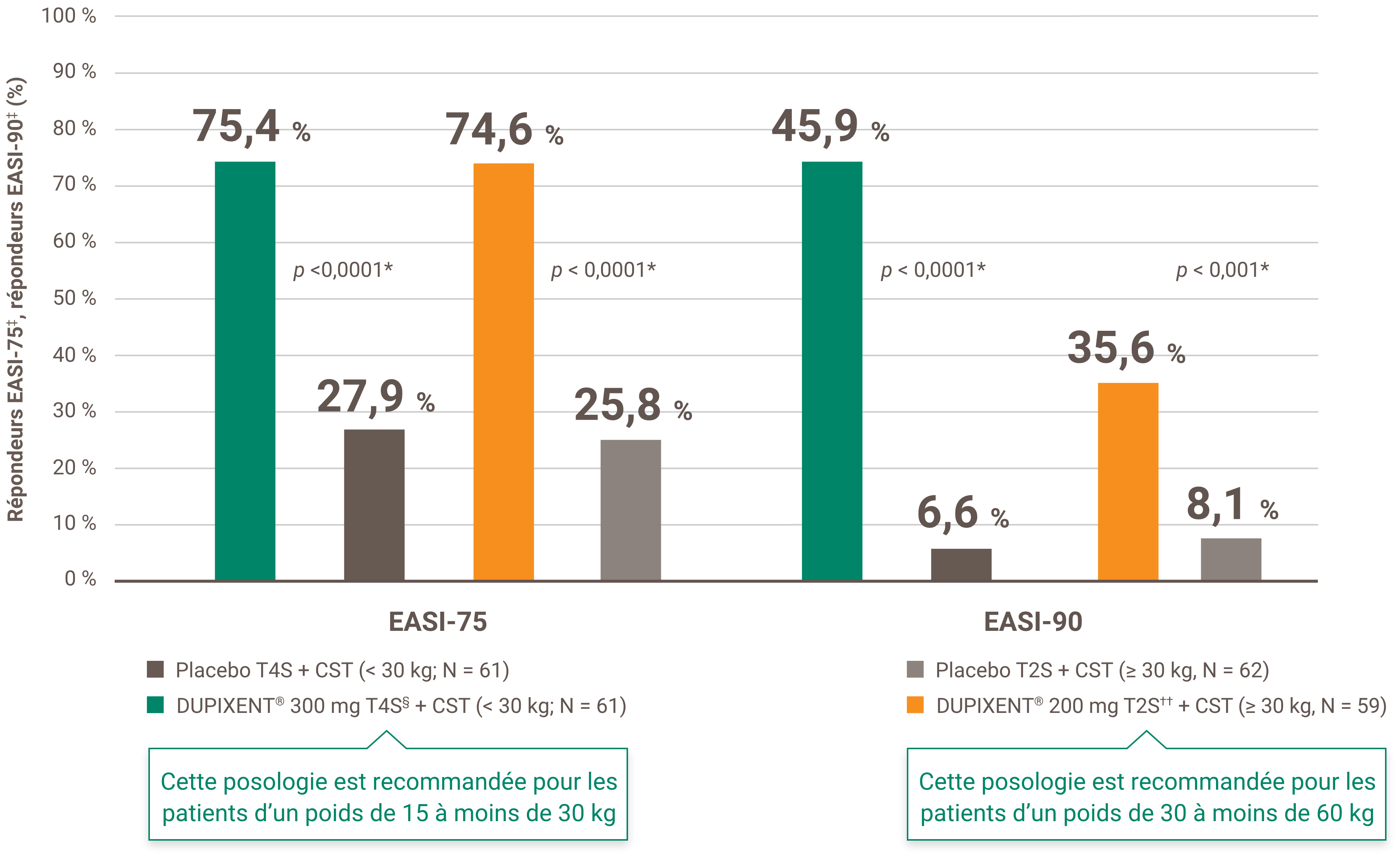
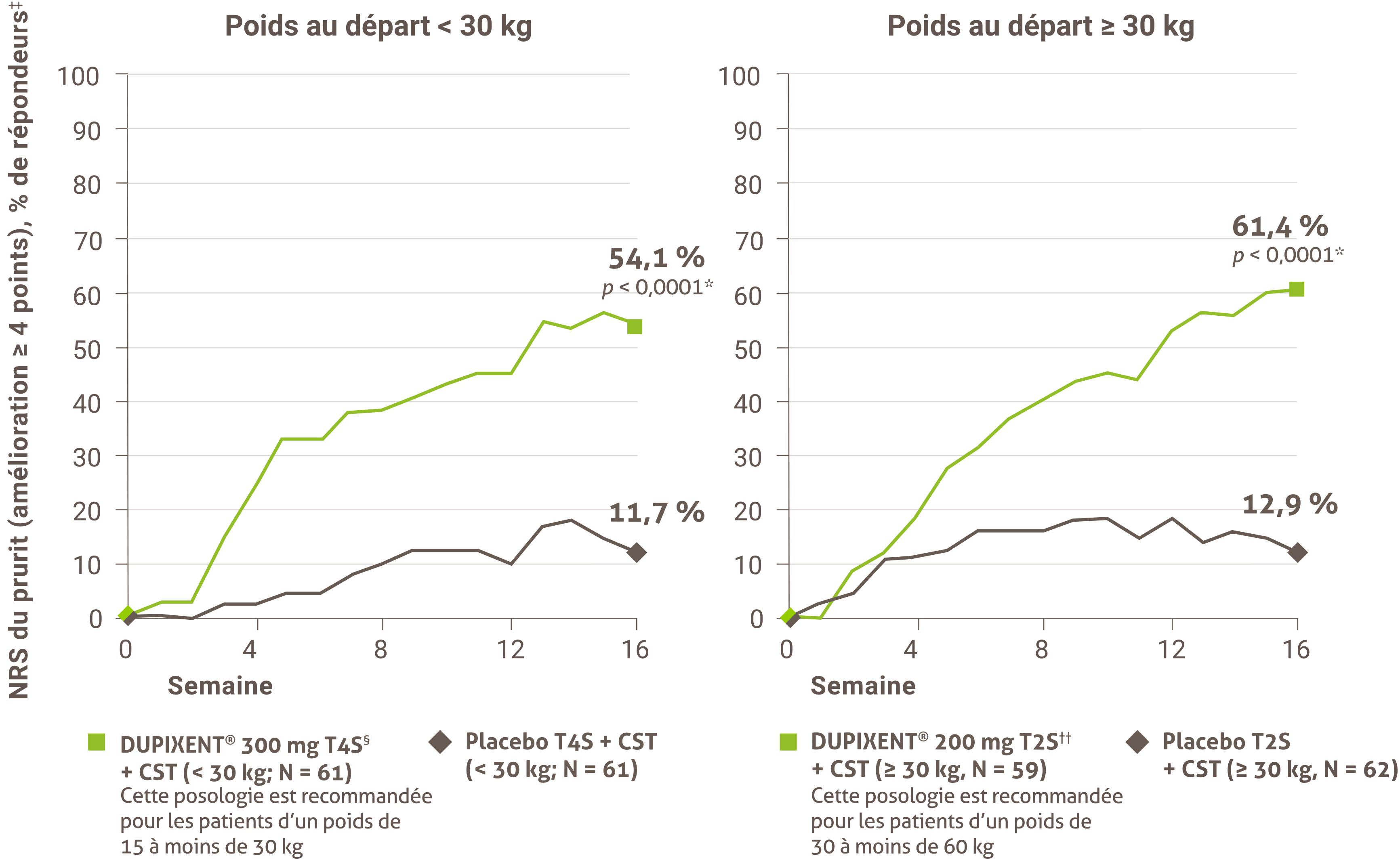
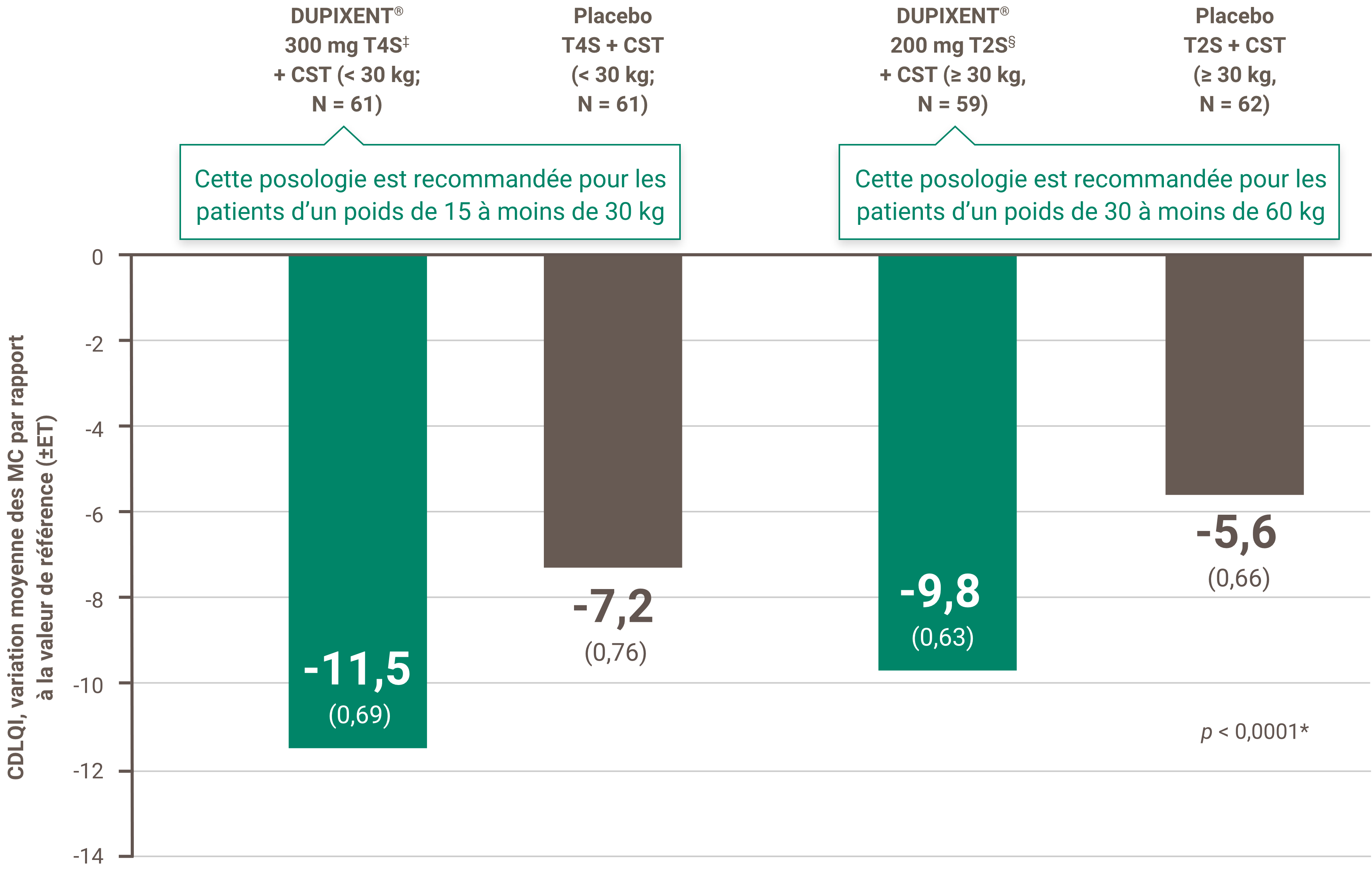
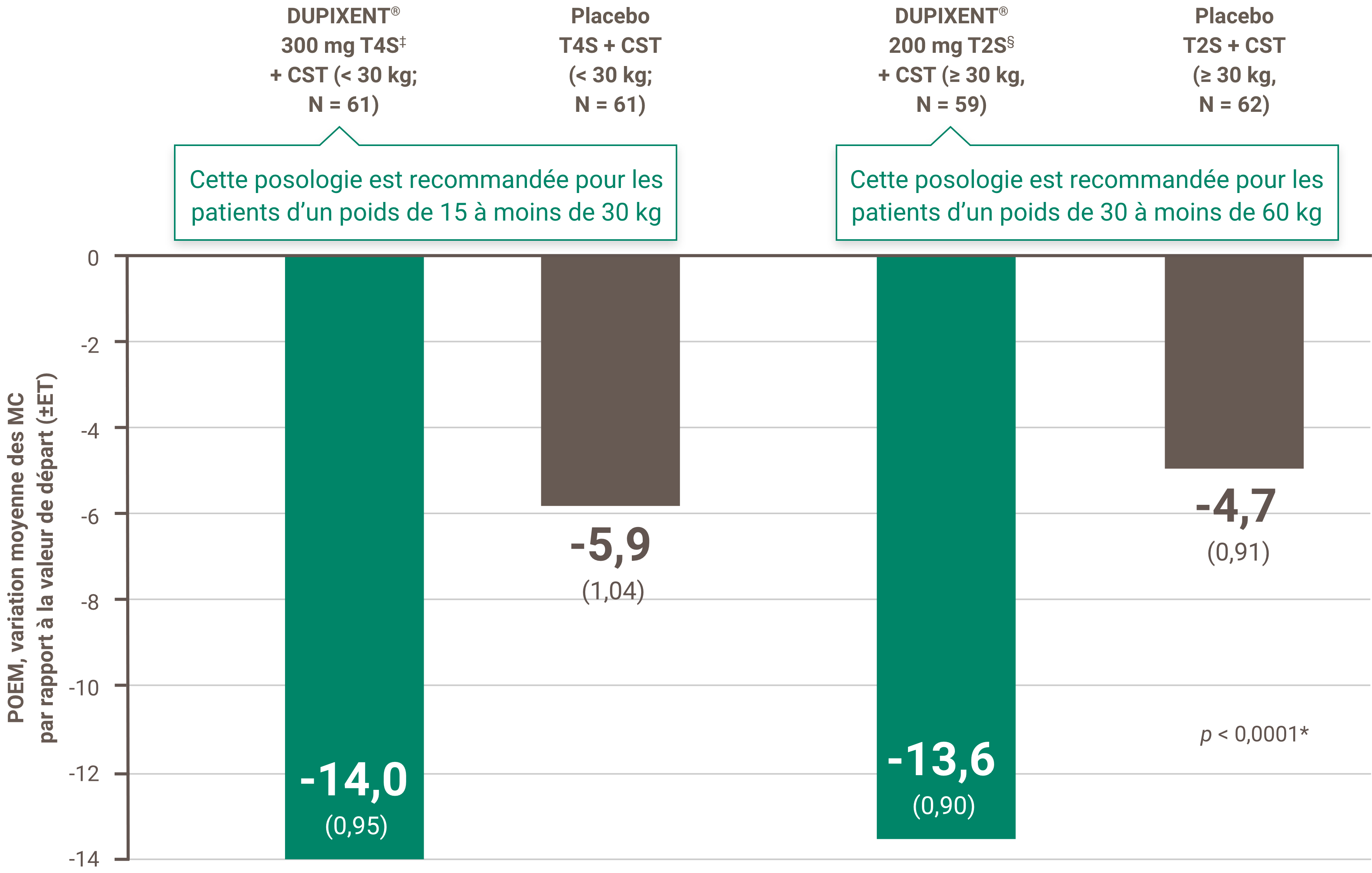
La réduction des démangeaisons était l’un des principaux critères d’évaluation secondaires lors d’un essai multicentrique, à répartition aléatoire, à double insu et contrôlé par placebo visant à évaluer l’efficacité et l’innocuité de DUPIXENT® + CST sur 16 semaines chez 367 patients pédiatriques (6 à 11 ans) atteints de DA sévère dont la maladie n’était pas adéquatement contrôlée par des médicaments topiques1. Cliquez ici pour obtenir des renseignements supplémentaires concernant la conception des essais cliniques.
À la semaine 16 :1,4†
• 54,1 % des patients traités par DUPIXENT® à 300 mg toutes les quatre semaines + CST (< 30 kg)‡ comparé à 11,7 % dans le groupe placebo ont obtenu une amélioration de ≥ 4 points sur l’échelle NRS du prurit (valeur p nominale < 0,05)
• 61,4 % des patients traités par DUPIXENT® à 200 mg toutes les deux semaines + CST (≥ 30 kg)§ comparé à 12,9 % dans le groupe placebo ont obtenu une amélioration de ≥ 4 points sur l’échelle NRS du prurit (valeur P nominale < 0,001)
Une proportion plus grande des sujets répartis de façon aléatoire pour recevoir DUPIXENT®+ CST ont obtenu une amélioration sur l’échelle NRS du prurit maximal par rapport au placebo + CST (définie comme une amélioration ≥ 4 points à la semaine 4).1
† Les sujets qui ont reçu un traitement de secours ou pour lesquels il manquait des données ont été classés comme non-répondants.
‡ Les sujets ont reçu une dose initiale de 600 mg de dupilumab. Une posologie de DUPIXENT® à 300 mg toutes les quatre semaines + CST est recommandée pour les patients dont le poids est de 15 kg sans excéder 30 kg.
§ Les sujets ont reçu une dose initiale de 400 mg de dupilumab. Une posologie de DUPIXENT® 200 mg T2S + CST est recommandée pour les patients dont le poids est de 30 kg sans excéder 60 kg.
Essais cliniques
CHRONOS a été un essai clinique pivot de 52 semaines évaluant l’efficacité et le profil d’innocuité du DUPIXENT® chez des patient(e)s atteints de dermatite atopique modérée à grave inadéquatement maîtrisée au moyen de traitements topiques sous ordonnance ou pour lesquel(le)s de tels traitement n’étaient pas conseillés. Les 421 patient(e)s adultes inscrits à CHRONOS ont été réparti(e)s aléatoirement pour recevoir le DUPIXENT® + une administration concomitante de CST ou un placebo + CST.1,5
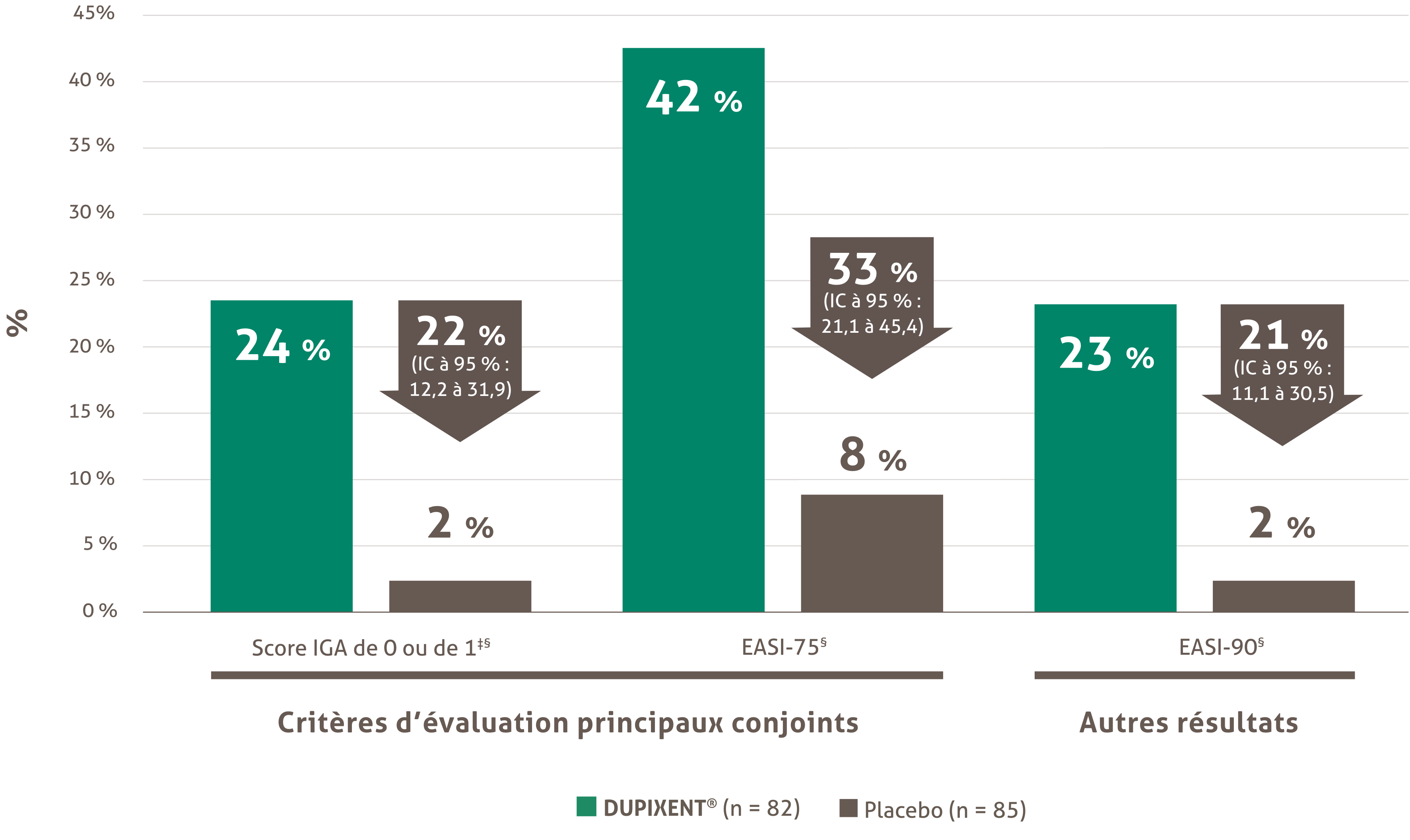
La gravité de la maladie était définie par un score IGA de ≥ 3 dans l’évaluation globale de la gravité des lésions de dermatite atopique sur une échelle allant de 0 à 4, un score EASI de ≥ 16 sur une échelle allant de 0 à 72 et une surface corporelle atteinte d’au moins 10%.1
Les études ont démontré une amélioration significative avec le DUPIXENT® + CST, la peau étant devenue claire (IGA 0) ou presque claire (IGA 1) (le critère d'évaluation principal à 16 semaines).1,5
• 39 % des patient(e)s adultes traité(e)s avec le DUPIXENT® + CST ont obtenu une peau claire ou presque claire à 16 semaines vs 12 % avec le placebo + CST (p < 0,0001)1,5
• 36 % des patient(e)s adultes ont obtenu une peau claire ou presque claire (IGA 0 ou 1) avec le DUPIXENT® + CST à 52 semaines vs 13 % avec le placebo + CST (p < 0,0001)1,5
• 69 % des patient(e)s adultes traité(e)s avec le DUPIXENT® + CST ont démontré une amélioration de leur score EASI-75 à 16 semaines vs 23 % avec le placebo + CST (p < 0,0001)1,5
Les réactions indésirables les plus fréquentes (incidence ≥ 1 %) observées à la semaine 16 ont été des réactions au site de l’injection, la conjonctivite, la blépharite, l’herpès buccal, la kératite, le prurit oculaire, d’autres infections par le virus de l’herpès simplex, l’éosinophilie et la sécheresse des yeux.1
De plus, le profil d’innocuité du DUPIXENT® + CST jusqu’à la semaine 52 correspondait généralement au profil d’innocuité observé à la semaine 16.1
L’innocuité de DUPIXENT® a été évaluée dans le cadre d’une étude menée chez 250 patients âgés de 12 à 17 ans atteints d’une forme modérée ou sévère de dermatite atopique. Le profil d’innocuité établi pour DUPIXENT® chez ces patients, qui ont été suivis pendant 16 semaines, était compatible avec celui dressé lors des études réalisées chez des adultes atteints de dermatite atopique.1
L’innocuité à long terme de DUPIXENT® a été évaluée au moyen d’une étude de prolongation menée en mode ouvert chez des patients âgés de 12 à 17 ans atteints d’une forme modérée ou sévère de dermatite atopique (AD-1434). Le profil d’innocuité établi pour DUPIXENT® chez ces patients suivis pendant 52 semaines était semblable à celui dressé à la semaine 16 de l’étude AD-1526. En gros, le profil d’innocuité de DUPIXENT® observé chez les adolescents correspondait à celui observé chez les adultes atteints de dermatite atopique.1
L’innocuité de DUPIXENT® a été évaluée dans le cadre d’un essai mené chez 367 patients âgés de 6 à 11 ans atteints de dermatite atopique sévère (AD-1652). Le profil d’innocuité pour DUPIXENT® + CST chez ces patients jusqu’à la semaine 16 correspondait au profil d’innocuité établi lors des études réalisées chez des adultes et des adolescents atteints de dermatite atopique.1
L’innocuité à plus long terme de DUPIXENT® + CST a été évaluée dans une étude de prolongation menée en mode ouvert de 52 semaines chez 368 patients âgés de 6 à 11 ans atteints de dermatite atopique (AD-1434), qui ont participé à une étude précédente sur la dermatite atopique portant sur DUPIXENT®. Le profil d’innocuité de DUPIXENT® + CST chez les sujets qui ont été suivis jusqu’à la semaine 52 dans l’étude AD-1434 correspondait à celui observé à la semaine 16 dans l’étude AD-1652.1
Dans l’ensemble, le profil d’innocuité de DUPIXENT® + CST observé chez les enfants correspondait à celui observé chez les adultes et les adolescents atteints de dermatite atopique.1
Utilisation du DUPIXENT®
La posologie de DUPIXENT® recommandée chez les adultes est constituée d’une dose initiale de deux injections (600 mg), puis d’une seule injection (300 mg) toutes les 2 semaines.
La dose recommandée chez les patients adolescents et pédiatriques (âgés de 6 à 17 ans) est déterminée en fonction de leur poids corporel :

Le DUPIXENT® peut être utilisé avec ou sans CST.1
L’étude de 52 semaines chez les adultes a été conçue afin d’évaluer le traitement avec le DUPIXENT® en association avec des CST à la semaine 16, ainsi que l’efficacité et le profil d’innocuité à long terme à la semaine 52.1,5
Le profil d’innocuité du DUPIXENT® + CST jusqu’à la semaine 52 correspondait généralement au profil d’innocuité observé à la semaine 16.1
Les réactions indésirables les plus fréquentes (incidence ≥ 1 %) observées à la semaine 16 ont été des réactions au site de l’injection, la conjonctivite, la blépharite, l’herpès buccal, la kératite, le prurit oculaire, d’autres infections par le virus de l’herpès simplex, l’éosinophilie et la sécheresse des yeux.1
Oui, le DUPIXENT® peut être utilisé de manière concomitante avec les inhibiteurs topiques de la calcineurine (ITC), mais comme il est indiqué sur l’étiquette du DUPIXENT®, ils ne devraient être utilisés que sur les zones problématiques comme le visage, le cou, les régions intertrigineuses et génitales.1
Lors de l’essai CHRONOS de 52 semaines, les patient(e)s étaient autorisé(e)s à utiliser des ITC au besoin sur les zones problématiques seulement.5
Pour obtenir plus de détails sur l’utilisation concomitante du DUPIXENT® et la posologie, veuillez consulter la section Posologie et administration de ce site Web.
![]()
Posologie et administration
Vous songez à prescrire du DUPIXENT®? Renseignez-vous et partez du bon pied.
![]()
Communiquez avec un représentant
Vous avez des questions concernant le DUPIXENT®? Obtenez des réponses auprès d’un représentant.
Les logos de DUPIXENT®, de Sanofi et de Liberté sont des marques déposées de Sanofi, utilisées sous licence par sanofi-aventis Canada inc.
REGENERON® est une marque déposée de Regeneron Pharmaceuticals, Inc. Tous droits réservés.
© 2023 sanofi-aventis Canada inc. Tous droits réservés.
MAT-CA-2300298F
Dernière révision : 06/2023